
����Ŀ����֪��Ӧ2CH3OH(g) ![]() CH3OCH3(g)��H2O(g)����ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ���е�ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3(g)��H2O(g)����ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ���е�ijʱ�̲�ø���ֵ�Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
Ũ��/mol��L��1 | 0.44 | 0.6 | 0.6 |
������������ȷ����(����)
A.�÷�Ӧ��ƽ�ⳣ������ʽΪK��![]()
B.ƽ��ʱc(CH3OH)��0.04 mol��L��1
C.��ʱ�������淴Ӧ���ʵĴ�С��v����v��
D.������CH3OH��10 min��Ӧ�ﵽƽ�⣬��ʱ���ڷ�Ӧ����v(CH3OH)��1.6 mol��L��1��min��1
���𰸡�B
��������
A.2CH3OH(g) ![]() CH3OCH3(g)��H2O(g)��ƽ�ⳣ������ʽK=
CH3OCH3(g)��H2O(g)��ƽ�ⳣ������ʽK=![]() ����A����
����A����
B.�ɱ������ݿ�֪���״�����ʼŨ��Ϊ0.44mol/L+2��0.6mol/L=1.64mol/L����ƽ���c(CH3OCH3)=xmol/L�����ݷ���ʽ��֪ƽ��ʱc(CH3OH)=(1.642x)mol/L��c(H2O)=xmol/L����![]() =400�����x=0.8����10min�ﵽƽ�⣬��ʱc(CH3OH)=0.04mol/L����B��ȷ��
=400�����x=0.8����10min�ﵽƽ�⣬��ʱc(CH3OH)=0.04mol/L����B��ȷ��
C. Ũ����Qc=![]() =1.34<K=400����Ӧ������Ӧ���У���ʱ�����淴Ӧ���ʵĴ�С��v��>v������C����
=1.34<K=400����Ӧ������Ӧ���У���ʱ�����淴Ӧ���ʵĴ�С��v��>v������C����
D.10min�ﵽƽ��ʱ����Ӧ����v(CH3OH)=![]() =0.16mol/(Lmin)����D����
=0.16mol/(Lmin)����D����
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00 mL 0.100 mol��L��1 CH3COONa��Һ����μ���0.100 0 mol��L��1���ᣬ��Һ��pH��������������Ĺ�ϵ����ͼ��ʾ(�����ǻӷ�)������˵����ȷ����

A. �����ʾ��Һ�У�c(CH3COOH)��c(Cl��)��c(OH��)��c(H��)
B. �����ʾ��Һ�У�c(Na��)��c(Cl��)��c(CH3COO��)��c(CH3COOH)
C. �����ʾ��Һ�У�c(CH3COOH)��c(Na��)��c(H��)��c(CH3COO��)
D. ���������п��ܳ��֣�c(H��)��c(Na��)��c(CH3COOH)��c(CH3COO��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ѧϰ��ѧ�Ĺ��ߺͻ����������йػ�ѧ����ı�����ȷ����
A. H2S �ĵ��뷽��ʽ��H2S��2H����S2��
B. �Ȼ�淋ĵ���ʽ��![]()
C. HClO�ĽṹʽΪ��H-O-Cl
D. ��Ӧ�ĵ���ת�������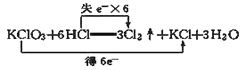
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ�������������������Ҫ���á�
(1)������һ����Ҫ�Ļ���ԭ�ϣ���̬�����dz��õķ��ϡ�
�������ϳɰ���������ط�ӦΪ:N2(g)+3H2(g)![]() 2NH3(g) ��H=-93kJ/mol��ʵ�������У����ù���������Fe�������������¶�773K��ѹǿ3.0��107Pa��ԭ������N2��H2���ʵ���֮��Ϊ1��2.8��
2NH3(g) ��H=-93kJ/mol��ʵ�������У����ù���������Fe�������������¶�773K��ѹǿ3.0��107Pa��ԭ������N2��H2���ʵ���֮��Ϊ1��2.8��
�ٺϳɰ������ǵ��Ĺ̶���һ�֣�����______(ѡ���������̵�����������̵������˹��̵���)��
�ںϳɰ���Ӧ��������ý���������й��ڴ�����˵������ȷ����_________��
A.���Լӿ췴Ӧ���� B.���Ըı䷴Ӧ��
C.���Լ��ٷ�Ӧ�е��ܺ� D.�������ӻ���ӵ���Ŀ
�۹��ںϳɰ����յ��������⣬��ȷ����_________��
A.ԭ������N2����������N2����ã��ʶȹ������������H2��ת����
B.�����¶�(773K)Զ�������£���Ϊ�˱�֤�����ܸߵ�ƽ��ת���ʺͿ�ķ�Ӧ����
C.���¶ȡ�ѹǿһ��ʱ����ԭ����(N2��H2�ı�������)�����������������壬���������ƽ��ת����
D.��������ɵ�N2��ͨ����Ȼ����ˮ����ת���ɵ�H2��ԭ�����뾭�������������Է�ֹ�����ж��Ͱ�ȫ�¹ʷ���
(2)��(N2H4)�ǵ����⻯��֮һ�����Ʊ��������ô����������������İ�����
�ٴ���������Һ�Լ��ԣ���ʾԭ�������ӷ���ʽ��_________________________��
�ڳ����£���ˮ�ⷴӦ��ƽ�ⳣ��ΪK=1.0��10-6mol/L����1.0mol/LNaClO��Һ��pH=____��
������N2O4������Ӧ����N2��ˮ������
��֪��N2(g)+2O2(g)=N2O4(l) ��H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ��H=-534.2kJ/mol
��д���º�N2O4��Ӧ���Ȼ�ѧ��Ӧ����ʽ_________________________________��
(3)��NH4HCO3��Һ�У���ӦNH4++HCO3-+H2O![]() NH3��H2O+H2CO3��ƽ�ⳣ��K=_____��(��֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2CO3�ĵ���ƽ�ⳣ��Ka1=4��10-7)��
NH3��H2O+H2CO3��ƽ�ⳣ��K=_____��(��֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2CO3�ĵ���ƽ�ⳣ��Ka1=4��10-7)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ��������Ǻϳ������ص�ԭ��֮һ����ṹ��ͼa��ʾ�������йض��ǻ��������˵����ȷ����

A. �����ǻ����������ֹ�����
B. ����ʹ����KMnO4��Һ��ɫ
C. �����Ķ��ǻ�����������Na��NaHCO3�����ʵ���֮��Ϊ3:1
D. �����ᣨ�ṹ��ͼb����ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������о������������к��еĿ�������ij�ֿ��������ijɷ�֮һ���������е������ɻ���������ã�ʹ�˵�����Ѫ�ܸ����ᡣ����������ģ����ͼ��ʾ(ֻ����̼����)�������йؿ�����������в���ȷ����(����)
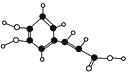
A.������ķ���ʽΪC9H8O4
B.�������к��еĹ�����ֻ���Ȼ����ǻ�
C.��������Է���������Ӧ��������Ӧ���Ӿ۷�Ӧ
D.![]() �ǿ������һ��ͬ���칹�壬1 mol��������NaOH��Һ��Ӧʱ�������NaOH�����ʵ���Ϊ3 mol
�ǿ������һ��ͬ���칹�壬1 mol��������NaOH��Һ��Ӧʱ�������NaOH�����ʵ���Ϊ3 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������C9H10O2������ˮ����ζ������������ˮ�㾫�����쾫�ͣ���������ʳƷ��ҵ�У�Ҳ�������л��ϳ��м��塢�ܼ��ȣ����Ʊ�����Ϊ��
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
��֪��
��ɫ��״̬ | �е㣨�棩 | �ܶȣ�gcm��3�� | |
������* | ��ɫƬ״���� | 249 | 1.2659 |
���������� | ��ɫ����Һ�� | 212.6 | 1.05 |
�Ҵ� | ��ɫ����Һ�� | 78.3 | 0.7893 |
������ | ��ɫ����Һ�� | 80.8 | 0.7318 |
*��������100���Ѹ��������ʵ�鲽�����£�
����Բ����ƿ�м���12.20g�����ᡢ25mL�Ҵ�����������20mL�����飬�Լ�4mLŨ���ᣬ��Ͼ��Ȳ������ʯ������ͼ��ʾװ�������������¶���6570����Ȼ���2h����Ӧʱ������һ�Ҵ���ˮ���γɡ���������е�62.6�棩��������������÷�ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��������������Ҵ���
�ڷ�Ӧ�������������ų���ˮ����Һ��ر��������������ȣ�����ˮ�����ռ�����Һ�岻���������ӣ�ֹͣ���ȣ�
�۽���ƿ�ڷ�ӦҺ����ʢ������ˮ���ձ��У���������Na2CO3����Һ�����ԣ�
���÷�Һ©���ֳ��л��㣬ˮ����25mL������ȡ��Һ��Ȼ��ϲ����л��㣮�����Ȼ��ƣ��Դֲ����������װ����ͼ��ʾ���������������Ѻ������£�����210213�����֣�
�ݼ���ϸ�ò�Ʒ���Ϊ13.16mL��
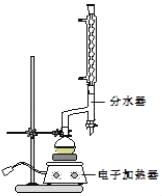
��1���ڸ�ʵ���У�Բ����ƿ���ݻ����ʺϵ���_____��������ȷѡ��ǰ����ĸ����
A.25mL B.50mL C.100mL D.250mL
��2��������з�ʯ��������____��ʹ�÷�ˮ�����Ϸ����ȥˮ��Ŀ����_____��
��3�������Ӧ������ֵ��¶���__��
A.215220�� B.8590�� C.7880�� D.6570��
��4������ۼ���Na2CO3��������________����Na2CO3���벻�㣬��֮������ʱ��������ƿ�пɼ����������ɣ������������ԭ����________��
��5�����ڲ�����е���ȡ��Һ����������ȷ����____��
A��ˮ��Һ�м������ѣ�ת������Һ©���У����ϲ���������Һ©����ת������������ҡ
B����ҡ���κ����Һ©���¿ڵIJ���������
C����������ҡ���������ֳַ�Һ©�����ô�Һ��ֲ�
D���ų�Һ��ʱ��Ӧ���Ͽڲ������������ϵİ��۶�©�����ϵ�С��
��6�����㱾ʵ��IJ���Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ����![]()
![]() ��ˮ�е���
��ˮ�е���![]() �����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ����֪
�����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ����֪![]() ��ˮ�ĵ����Ϊ
��ˮ�ĵ����Ϊ![]() �������й�������ȷ����
�������й�������ȷ����
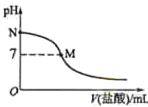
A.�õζ�����Ӧ��ѡ��ʯ����Ϊָʾ��
B.M���Ӧ���������Ϊ![]() mL
mL
C.M�㴦����Һ��![]()
D.N�㴦����Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D���ֽ������±���װ�ý���ʵ�顣
װ�� |
|
|
|
���� | ���۽���A�����ܽ� | C���������� | A����������� |
����ʵ������ش��������⣺
��1��װ�ü��и����ĵ缫��Ӧʽ��______________________________________��
��2��װ�����������ĵ缫��Ӧʽ��_______________________________________��
��3��װ�ñ�����Һ��pH________�����������������С����������������
��4�����ֽ��������ǿ������˳����___________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com