
【题目】298K时,在![]()
![]() 氨水中滴入
氨水中滴入![]() 的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知
的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知![]() 氨水的电离度为
氨水的电离度为![]() ,下列有关叙述正确的是
,下列有关叙述正确的是
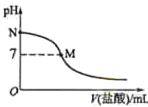
A.该滴定过程应该选择石蕊作为指示剂
B.M点对应的盐酸体积为![]() mL
mL
C.M点处的溶液中![]()
D.N点处的溶液中![]()
【答案】D
【解析】
A、强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,所以应选择甲基橙作指示剂;
B、如果M点盐酸体积为![]() ,则二者恰好完全反应生成氯化铵,溶液应该呈酸性;
,则二者恰好完全反应生成氯化铵,溶液应该呈酸性;
C、M处溶液呈中性,则存在![]() ,根据电荷守恒得
,根据电荷守恒得![]() ,该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制;
,该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制;
D、N点为氨水溶液,氨水浓度为![]() ,该氨水电离度为
,该氨水电离度为![]() ,则该溶液中
,则该溶液中![]() ,
,![]() 。
。
A、强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,而石蕊的变色范围为![]() ,无法控制滴定终点,应选择甲基橙作指示剂,故A错误;
,无法控制滴定终点,应选择甲基橙作指示剂,故A错误;
B、如果M点盐酸体积为![]() ,则二者恰好完全反应生成氯化铵,氯化铵中铵根离子水解导致该点溶液应该呈酸性,要使溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于
,则二者恰好完全反应生成氯化铵,氯化铵中铵根离子水解导致该点溶液应该呈酸性,要使溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于![]() ,故B错误;
,故B错误;
C、M处溶液呈中性,则存在![]() ,根据电荷守恒得
,根据电荷守恒得![]() ,该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制,水的电离程度很小,该点溶液中离子浓度大小顺序是
,该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制,水的电离程度很小,该点溶液中离子浓度大小顺序是![]() ,故C错误;
,故C错误;
D、N点为氨水溶液,氨水浓度为![]() ,该氨水电离度为
,该氨水电离度为![]() ,则该溶液中
,则该溶液中![]() ,
,![]() ,所以该点溶液
,所以该点溶液![]() ,故D正确;
,故D正确;
故选:D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,用浓度为![]() 的盐酸分别逐滴加入到
的盐酸分别逐滴加入到![]() 的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是
的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是![]()
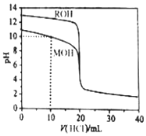
A.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度的关系是:![]()
C.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
D.![]() 时,不可能存在:
时,不可能存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g) ![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A.该反应的平衡常数表达式为K=![]()
B.平衡时c(CH3OH)=0.04 mol·L-1
C.该时刻正、逆反应速率的大小:v正<v逆
D.若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是

A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.相同条件下,测得![]() 溶液的pH大于相同物质的量浓度的
溶液的pH大于相同物质的量浓度的![]() 溶液,说明非金属性:
溶液,说明非金属性:![]()
B.绝热容器中,向50mL1![]() 的盐酸中加入烧碱,水的
的盐酸中加入烧碱,水的![]() 不变
不变
C.相同温度时,![]() 分别在相同物质的量浓度的
分别在相同物质的量浓度的![]() 溶液和
溶液和![]() 溶液中的溶解度相同
溶液中的溶解度相同
D.有HX和HY两种弱酸且酸性![]() ,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有
,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别用浓度均为![]() 的
的![]() 和NaOH溶液,滴定
和NaOH溶液,滴定![]() 溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是
溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是![]()
![]()
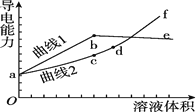
A.曲线2代表滴加![]() 溶液的变化曲线
溶液的变化曲线
B.b和d点对应的溶液均显碱性
C.b点溶液中![]()
D.![]() 段导电能力升高的原因是发生了反应
段导电能力升高的原因是发生了反应![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中含有吸入颗粒物PM2.5,严重影响人的生理和健康,因此改善发质结构、机动车辆措施能有效减少PM2.5、SO2、NO3等的污染。请回答下列问题:
(1)将一定量的某PM2.5样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下,测得该试样的组成及其浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断,该试样的pH = ________。
(2)汽车尾气中NOx和CO的生成。已知:气缸中生成NO的反应为N2(g)+O2(g)![]() 2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
A.混合气体的密度不再变化 B.混合气体的平均分子质量不再变化
C.N2、O2、NO的物质的量之比为1:1:2 D.氧气的转化率不再变化
E.生成lmol N2的间时有lmol O2被消耗
(3)为减少CO2、SO2的排放,常采取的措施如下:
①将煤转化为淸洁气体燃料。己知:H2(g)+1/2O2(g)= H2O(g) △H =-241.8kJ mol-1; C(s)+1/2O2(g)=CO(g) △H =-110.5kJ mol-1。写出焦炭与水蒸气反应的热化学方程式:_____________________________________。
②洗涤含SO2的烟气。下列物质,可作为洗涤含SO2烟气的洗涤剂的是______(填序号)。
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl3饱和溶液 D.酸性CaCl2饱和溶液
(4)某湿度下,反应2NO(g)+O2(g) ![]() 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
判断的依据是__________________________________。
(5)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池的工作原理如图14所示,则通入a气体的电极,电极反应式为_________________。

(6)—定条件下,甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH溶液与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示,该混合溶液中醋酸的电离常数为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应的离子方程式是:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
回答下列问题:
(1)用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液;
(2)该滴定实验选用何种指示剂,说明理由____________________(如无需加入指示剂也请说明理由);
(3)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com