
【题目】在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体.在同温、同压下,两容器内的气体一定具有相同的是( )
A.原子数
B.相对分子质量
C.质量
D.密度
【答案】A
【解析】解:同温同压下,气体摩尔体积相等,体积相等的不同气体其物质的量相等.A.根据N=nNA知,二者的物质的量与分子数成正比,物质的量相等则其分子数相等,每个分子中原子个数相等,所以其原子总数相等,故A正确;
B.盛有H2和Cl2的混合气体的容器中两种气体的物质的量的关系不知道,所以不能求出混合气体的平均摩尔质量,则二者的摩尔质量不一定相等,故B错误;
C.根据m=nM知,物质的量相等时,二者的质量与其摩尔质量成正比,二者的摩尔质量不一定相等,所以其质量不一定相等,故C错误;
D.根据ρ= ![]() 知,密度与其摩尔质量成正比,两个容器中平均摩尔质量不一定相等,所以其密度不一定相等,故D错误;
知,密度与其摩尔质量成正比,两个容器中平均摩尔质量不一定相等,所以其密度不一定相等,故D错误;
故选:A.


科目:高中化学 来源: 题型:
【题目】已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
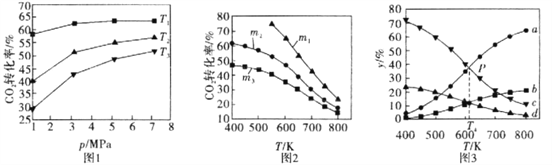
(1)图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=![]() 。
。
①图l中投料比相同,温度从高到低的顺序为________。
②图2中.m1、m2、m3投料比从大到小的顺序为________,理由是________。
(2)图3表示在总压为5MPa的恒压条件下,且m=3时,不同温度下各物质的物质的量分数与温度的关系。
①曲线b代表的物质为________(填化学式)。
②图3中P点时。CO2的转化率为________。
③T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入01mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( ) 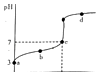
A.a点表示溶液中c(CH3COO﹣)﹣定为10﹣3 mol/L
B.b点表示的溶液中c(Na+)<c(CH3COO﹣)
C.c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中 ![]() 大于K
大于K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在证明海带中存在碘元素的实验操作中,主要仪器选用错误的是( )
选项 | 操作 | 主要仪器 |
A | 称取3.0g干海带 | 托盘天平 |
B | 灼烧干海带至完全变成灰烬 | 蒸发皿 |
C | 过滤煮沸后的海带灰与水的混合液 | 漏斗 |
D | 用四氯化碳从氧化后的海带灰浸取液中提取碘 | 分液漏斗 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。D、F、G、H均为常见气体,其中D能使湿润的红色石蕊试纸变蓝;G呈绿色,H在空气中含量最高;C的摩尔质量为32g/mol;E为难溶性碱。
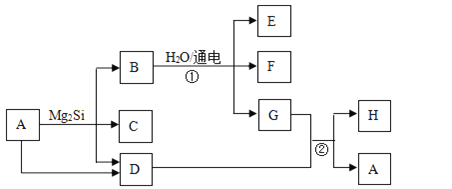
(1)C的化学式为_________。
(2)H的电子式为_________。
(3)写出反应①的离子方程式: _________。
(4)写出反应②的化学方程式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
(1)原混合物中Na2SO4的物质的量浓度;
(2)在标准状况下产生气体的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
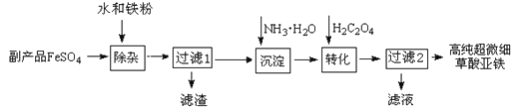
已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3
②5Fe2+ +MnO4- +8H+ =5Fe3+ +Mn2+ +4H2O 5C2O42- +2MnO4- +16H+ =10CO2↑+2Mn2+ +8H2O
(1)除杂过程中加入Fe的作用是___________________________。
(2)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2mol·L-1 的H2SO4溶解。
步骤2:用c mol·L-1标准KMnO4溶液滴定,消耗其体积a mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液b mL。
① KMnO4溶液应该装在_______________滴定管中。
② 用KMnO4溶液滴定待测液,达到滴定终点的标志是__________________________________。
③ 下列操作会导致测定结果中样品的C2O42- 的物质的量偏大的是____________________
A. 步骤2中,滴定管未用标准KMnO4 溶液润洗
B. 步骤3中加入Zn不足
C. 步骤2中,读标准溶液体积时,先仰视后俯视
D. 步骤4中,读标准溶液体积时,先俯视后仰视
④ 样品中C2O42- 的物质的量为_______________________。
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+ 的浓度随反应时间t的变化如下图,其变化趋势的原因可能为__________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com