
【题目】已知醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则下列说法正确的是
A.实现该变化的只能是升高温度B.溶液的导电能力一定变强
C.溶液的pH一定减小D.发生电离的分子总数增多
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态铜原子的电子排布式为_______。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有______(填字母序号)。
,该配离子中含有的化学键类型有______(填字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含____molσ键,与CO互为等电子体的离子是__(填化学式,写一种)。
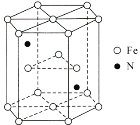
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为acm,高为ccm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法不正确的是![]()
A.酸雨样品露天放置一段时间,酸性增强,是因为发生了氧化还原反应
B.纳米铁粉可将地下水中的![]() 转化为
转化为![]() ,是因为纳米铁粉具有还原性
,是因为纳米铁粉具有还原性
C.将草木灰与![]() 混合施用,可更好为植物全面提供N、P、K三种营养元素
混合施用,可更好为植物全面提供N、P、K三种营养元素
D.生活中常用可溶性铝盐净水,可加速水中悬浮物沉降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的分解受多种因素的影响。实验测得
的分解受多种因素的影响。实验测得![]() 时不同条件下,
时不同条件下,![]() 浓度随时间变化如图所示,下列说法不正确的是
浓度随时间变化如图所示,下列说法不正确的是
A.图甲表明,其他条件相同时,![]() 的浓度越小,其分解速率越慢
的浓度越小,其分解速率越慢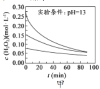
B.图乙表明,其他条件相同时,溶液pH越小,![]() 分解速率越慢
分解速率越慢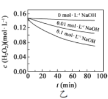
C.图丙表明,少量![]() 存在时,溶液碱性越强,
存在时,溶液碱性越强,![]() 分解速率越快
分解速率越快
D.图丙和图丁表明,碱性溶液中,![]() 对
对![]() 分解速率的影响大
分解速率的影响大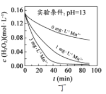
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电子层数相同的X、Y、Z三种主族元素,最高价氧化物的水化物的酸性为:![]() 。下列判断正确的是( )
。下列判断正确的是( )
A.三种元素的简单阴离子的还原性按Z、X、Y的顺序增强
B.单质的氧化性按X、Y、Z的顺序增强
C.原子半径按X、Y、Z的顺序增大
D.气态氢化物的稳定性按X、Y、Z的顺序减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.高压有利于合成氨的反应
B.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
C.红棕色的NO2,加压后颜色先变深后逐渐变浅
D.黄绿色的氯水光照后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaCl ②NaOH ③HCl ④NH4Cl ⑤CH3COONa ⑥CH3COOH ⑦NH3H2O ⑧H2O,回答下列问题.
(1)NH4Cl溶液显酸性,用离子方程式表示原因 ,其溶液中离子浓度大小顺序为 。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH﹣)= ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)= 。
(3)若将等pH、等体积的②NaOH和⑦NH3H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m n。(填“<”、“>”或“=”)
(4)若前五种溶液的物质的量浓度相同,用序号排出这五种溶液pH由大到小的顺序 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 表示放热反应,
表示放热反应,![]() 表示吸热反应
表示吸热反应
B.在化学反应中发生物质变化的同时,不一定发生能量变化
C.![]() 的大小与热化学方程式中化学计量数有关
的大小与热化学方程式中化学计量数有关
D.生成物释放的总能量大于反应物吸收的总能量时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酞菁钴被广泛应用于光电材料、光动力学光敏材料等方面。酞菁钴(II)结构如图所示(Co均形成单键,部分化学键未画明)。下列说法错误的是( )
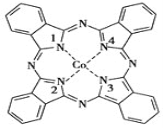
A.酞菁钴(II)中三种非金属元素的电负性大小顺序为N>C>H
B.酞菁钴(II)中碳原子的杂化方式只有sp2杂化
C.1号和3号N原子的VSEPR模型均为平面三角形
D.2号和4号N原子与Co(Ⅱ)是通过配位键结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com