
【题目】酞菁钴被广泛应用于光电材料、光动力学光敏材料等方面。酞菁钴(II)结构如图所示(Co均形成单键,部分化学键未画明)。下列说法错误的是( )
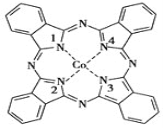
A.酞菁钴(II)中三种非金属元素的电负性大小顺序为N>C>H
B.酞菁钴(II)中碳原子的杂化方式只有sp2杂化
C.1号和3号N原子的VSEPR模型均为平面三角形
D.2号和4号N原子与Co(Ⅱ)是通过配位键结合
科目:高中化学 来源: 题型:
【题目】已知醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则下列说法正确的是
A.实现该变化的只能是升高温度B.溶液的导电能力一定变强
C.溶液的pH一定减小D.发生电离的分子总数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol。回答有关中和反应的问题。
(1)用0.1molBa(OH)2配成稀溶液与足量稀硝酸反应,能放出___kJ热量。
(2)如图装置中仪器A的名称___,作用是___;仪器B的名称___,作用是___;碎泡沫塑料的作用是___。
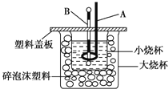
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ/mol,其原因可能是___。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得中和热的数值会___(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
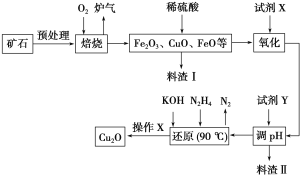
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气具有还原性,能够被氧化铜氧化,用如图中的装置可以实现该反应。已知氨可以与灼热的氧化铜反应得到氮气和金属铜。回答下列问题:
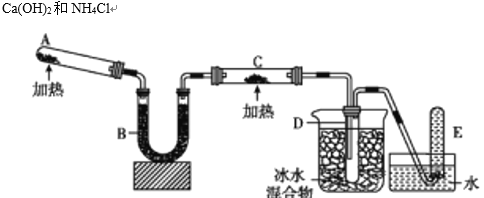
(1)写出A中反应方程式:________________。
(2)写出氨气与灼热氧化铜的反应方程式:________________。
(3)B中加入的干燥剂是________(填序号)
①浓硫酸 ②无水氯化钙 ③碱石灰
(4)能证明氨与氧化铜反应的现象是C中________。
(5)D中有无色液体生成。检验D中无色液体的成分时会用到下列哪一种药品________(填序号)
A.![]() B.
B.![]() C.无水硫酸铜
C.无水硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是( )
A.SO2氧化SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
B.500 ℃左右的温度比室温更有利于合成氮反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
C.H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D.实验室采用排饱和食盐水的方法收集氯气Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
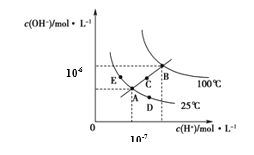
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A. 增大c(A)、c(B),K增大
B. 降低温度,正反应速率增大
C. 该反应的焓变为负值
D. 该反应的化学方程式为2E(g)+F(g)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是
A.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:![]() +2H2O=NH3·H2O+H3O+
+2H2O=NH3·H2O+H3O+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH+2H2O=2![]() +3H2↑
+3H2↑
C.用碳酸氢钠溶液检验水杨酸中的羧基: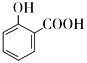 +2
+2![]() →
→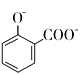 +2H2O+2CO2↑
+2H2O+2CO2↑
D.用高锰酸钾标准溶液滴定草酸:2![]() +16H++5
+16H++5![]() =2Mn2++10CO2↑+8H2O
=2Mn2++10CO2↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com