
【题目】下列有机物是按照碳骨架进行分类的是 ( )
A.烷烃B.烯烃
C.芳香族化合物D.卤代烃
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I、煤制天然气的工艺流程简图如下:

⑴反应I:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
⑵反应II:CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。

① 判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
② 若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是_______(填“T1”或“T2”或“T3”)。
⑶① 甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_______。
② 工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是_______。
II、利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境上的双重意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0
H>0
CH4超干重整CO2的催化转化原理示意如图:

⑷过程II,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
⑸假设过程I和过程II中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程I和过程II中均含有氧化还原反应
b.过程II中使用的催化剂为Fe3O4 和CaCO3
c.若过程I投料![]() ,可导致过程II中催化剂失效
,可导致过程II中催化剂失效
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的
H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的![]() H=________________。
H=________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:①2LiAlH4![]() 2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列说法正确的是
2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列说法正确的是
A. 若反应①中生成3.36L氢气,则一定有2.7g铝生成
B. 氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑
C. 生成等质量的氢气,反应①②转移电子数之比为4:3
D. LiAlH4是共价化合物,LiH是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+2Y(g)![]() Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )
Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )

A. 若向该容器中加入1molX、2molY,达平衡时,X的平衡浓度小于0.125mol/L
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
N2(g)+3H2(g)![]() 2NH3(g)△H=-92.60kJ/mol
2NH3(g)△H=-92.60kJ/mol
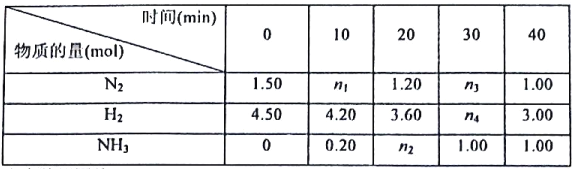
根据表中数据回答:
(1)反应进行到20min时放出的热量为__________kJ。
(2)0-10min内的平均反应速率v(N2)为__________mol/(L·min)
(3)此温度下该逆反应的化学平衡常数K(逆)=__________(保留两位小数).
(4)反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将__________(填“正向移动”或“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在工业上有广泛用途。请回答以下问题:
(1)工业上利用N2(g)+3H2(g) ![]() 2NH3(g) H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图。
2NH3(g) H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图。

①相对a而言,b可能改变的条件是____________,判断的理由是__________________;
②a条件下,0~t0的平均反应速率v(N2)=_____________mol·L-1·min-1;
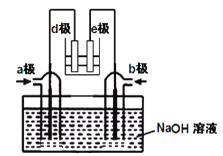
(2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝。
a极通入____气体(填化学式),判断的理由是___________________________________;
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,如图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。
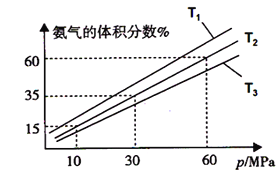
①能判断N2(g)+3H2(g) ![]() 2NH3(g)达到平衡的是______(填序号) ;
2NH3(g)达到平衡的是______(填序号) ;
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为_______________,
③此时N2的平衡分压为__________Mpa,(分压=总压×物质的量分数)
计算出此时的平衡常数Kp=________。(用平衡分压代替平衡浓度计算,结果保留2位有效数字并带上单位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下:
Ⅰ: 6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷) ↑+3H2O
Ⅱ: 2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布式__________
(2)砷烷的空间结构为_________;砷烷中心原子杂化方式为________
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3![]() AsH3
AsH3![]() SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
(4)第一电离能数据I(As)____ I(Se)
(5)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图所示。
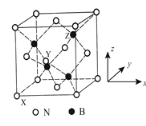
晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d gcm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com