


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
| A、从C(s,石墨)═C(s,金刚石)△H=+1.9 kJ?mol-1,可知石墨比金刚石更稳定 |
| B、等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C、由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ |
| D、2 g H2完全燃烧生成液态水放出 28 5.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、36gH2O和22.4LCO2中Si和O,C和O之间的共价键均是4×6.02×1023 |
| B、0.1 L 3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 |
| C、常温常压下,4.6 g NO2气体含有0.1×6.02×1023个NO2分子 |
| D、0.1 mol的甲基(-CH3)和羟基(-OH)所含电子数均为0.9×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
144 62 |
150 62 |
A、
| ||||
B、
| ||||
C、
| ||||
D、据
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15mol/L |
| B、0.2mol/L |
| C、0.3mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
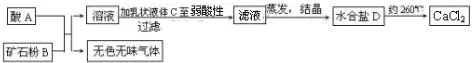
查看答案和解析>>
科目:高中化学 来源: 题型:
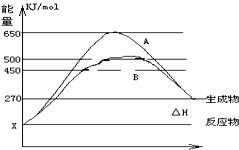 (1)已知:Fe(s)+
(1)已知:Fe(s)+| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com