
【题目】下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,F为棕黄色溶液。①是实验室制取丁的反应之一。各物质间的转化如下图所示,回答下列问题(部分生成物未列出):

(1)物质I的化学式为________;F中阴离子是______________;
(2)反应①的化学方程式为为____________;
(3)B与K的反应是实验室制取丙的反应,其离子方程式为____________;
(4)反应②的化学方程式为_____________;
(5)若E与G以物质的量比为1:1投入足量水中,反应的化学方程式为_________;生成1mol气体转移电子的个数为__________。
【答案】Fe(OH)3 Cl- 2H2O2![]() 2H2O+O2 MnO2+4H++2Cl-
2H2O+O2 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 3Fe + 4H2O(g)
Mn2++Cl2↑+2H2O 3Fe + 4H2O(g)![]() Fe3O4 +4H2 4FeCl2+4Na2O2 + 6H2O = 4Fe(OH)3↓+8NaCl + O2↑ 6NA
Fe3O4 +4H2 4FeCl2+4Na2O2 + 6H2O = 4Fe(OH)3↓+8NaCl + O2↑ 6NA
【解析】
丙为黄绿色单质气体,所以丙为Cl2,B与K的反应是实验室制取丙的反应,且B为黑色粉末,则B为MnO2,K为HCl;①是实验室制取丁的反应之一,则该反应为双氧水在二氧化锰的催化作用下制取氧气的反应,所以C为H2O,丁为氧气;G为淡黄色固体,且可以生成氧气,则G应为Na2O2,则J为生活中常见的调味品,应为NaCl,I为红褐色固体应为Fe(OH)3;F为棕黄色溶液,应含Fe3+,E与氯气反应可生成F,则F为FeCl3,E为FeCl2;氯化铁可以与单质铁反应生成氯化亚铁,所以甲为铁单质,Fe可以在高温条件下与水反应生成氢气和四氧化三铁,所以乙为氢气,D为Fe3O4。
(1)根据分析可知物质I为Fe(OH)3;F中阴离子为Cl-;
(2)反应①为双氧水在二氧化锰的催化作用下制取氧气,方程式为2H2O2![]() 2H2O+O2;
2H2O+O2;
(3)实验室利用浓盐酸和二氧化锰共热制取氯气,方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)反应②为Fe在高温条件下与水蒸气反应生成氢气和四氧化三铁的反应,方程式为:3Fe + 4H2O(g)![]() Fe3O4 +4H2;
Fe3O4 +4H2;
(5)E为FeCl2,G为Na2O2,过氧化钠有强氧化性可氧化亚铁离子为铁离子,被还原时-1价的氧被还原成-2价,二者1:1反应,说明氧化产物不止有Fe3+,再联系过氧化钠可以与水反应生成氧气,可知产物中应还有氧气,Na2O2自身发生氧化还原反应,所以E与G以物质的量比为1:1投入足量水中,反应方程式为4FeCl2+4Na2O2 + 6H2O = 4Fe(OH)3↓+8NaCl + O2↑。


科目:高中化学 来源: 题型:
【题目】如图为元素周期表短周期的一部分,下列关于X、Y、Z、M的说法中正确的是( )
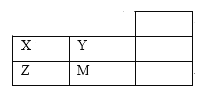
A. ZX2形成的晶体为分子晶体
B. Y的最高正价等于其最外层电子数
C. 原子半径:M>Z>Y
D. 非金属性:Z>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 胶体与溶液的本质区别在于是否可以发生丁达尔现象
B. 在常温下铁遇浓硫酸会钝化,所以可以用铁制容器来装运浓硫酸
C. 氯气具有漂白性,可以使湿润的有色布条褪色
D. 二氧化碳通入足量澄清石灰水中,没有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究氯、溴、硫的非金属性强弱,设计如下实验装置(加热及夹持装置已略)。

(1)仪器a的名称是______。试剂X是_____________。
(2)写出装置A中发生反应的化学方程式:__________________________________
(3)装置E中NaOH溶液的作用是____________________________________________
(4)反应一段时间后,观察到装置C中溶液变为橙黄色,说明非金属性:Cl___Br( 填“>"或"<")。
(5)打开装置C中的活塞,将装置C中的溶液逐渐滴人装置D中,振荡。观察到的现象是______________,写出可能发生反应的离子方程式:_____________________________________写一个即可),根据此现象不一定能说明溴的非金属性比硫强,原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化说法正确的是

A. 相同条件下,氢气和氧气反应生成液态水比生成等量的气态水所放出的热量少
B. 根据如图金刚石在一定条件下转化成石墨提供的信息,可知生成物比反应物稳定,过程中向外界放出热量为E2-E3
C. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D. 已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0kJ·mol-1
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ·mol-1
C(石墨)+O2(g)=CO2(g)△H=-393.5kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s)△H=-1641.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号。请参照元素A~I在周期表中的位置,回答下列问题。
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 | |
1 | A | |||||||
2 | B | C | D | E | ||||
3 | F | G | H | I |
(1)B、C两元素中非金属性较强的是________(写出元素名称),I元素在周期表中的位置是__________。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式_________。
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,请写出Y的电子式_________,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M,用电子式表示M的形成过程:____。
(4)表中某两种元素的气态单质可以形成燃料电池,其产物清洁无污染,请写出碱性环境中负极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用乙烯与甲苯为主要原料,按下列路线可合成有机物 E、F:
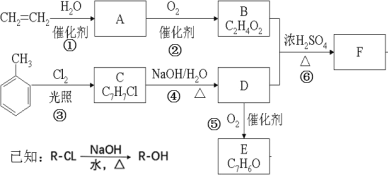
请回答:
(1)B 中官能团的名称是_________,反应⑥的反应类型是__________。
(2)D→E 的 化 学 方 程 式_________________________________。
(3)F 的 结 构 简 式___________________________。
(4)下列有关说法不正确的是_________。
A.E 能与新制的 Cu(OH)2 悬浊液发生反应,而 B 不能与新制的 Cu(OH)2 悬浊液发生反应
B.F 在碱性条件下可发生皂化反应
C. ![]() 不能使酸性 KMnO4 溶液褪色
不能使酸性 KMnO4 溶液褪色
D. 1mol E 和足量 H2 反应,最多消耗 4mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法净化水过程如图所示。下列说法中错误的是

A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的![]() 、
、![]() 、Cl通过阴离子树脂后被除去
、Cl通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s) ![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com