
ЁОЬтФПЁПЯТБэжаАЂРВЎЪ§зж(1ЁЂ2Ё)ЪЧдЊЫижмЦкБэжаааЛђСаЕФађКХЁЃЧыВЮеедЊЫиAЁЋIдкжмЦкБэжаЕФЮЛжУЃЌЛиД№ЯТСаЮЪЬтЁЃ
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 | |
1 | A | |||||||
2 | B | C | D | E | ||||
3 | F | G | H | I |
(1)BЁЂCСНдЊЫижаЗЧН№ЪєадНЯЧПЕФЪЧ________(аДГідЊЫиУћГЦ)ЃЌIдЊЫидкжмЦкБэжаЕФЮЛжУЪЧ__________ЁЃ
(2)БэжаФГдЊЫиФмаЮГЩСНадбѕЛЏЮяЃЌаДГіИУбѕЛЏЮяШмгкЧтбѕЛЏФЦШмвКЕФРызгЗДгІЗНГЬЪН_________ЁЃ
(3)БэжаФГдЊЫиЕФЕЅжЪдкГЃЮТЯТЮЊЦјЬЌЃЌИУдЊЫиФмгыAЁЋIжаЕФвЛжждЊЫиЙЙГЩдзгИіЪ§БШЮЊ1ЁУ1КЭ1ЁУ2ЕФСНжжЙВМлЛЏКЯЮяXКЭYЃЌЧыаДГіYЕФЕчзгЪН_________ЃЌИУдЊЫиЛЙФмгыAЁЋIжаЕФСэвЛжждЊЫивддзгИіЪ§жЎБШЮЊ1ЁУ1КЭ1ЁУ2аЮГЩСНжжРызгЛЏКЯЮяZКЭMЃЌгУЕчзгЪНБэЪОMЕФаЮГЩЙ§ГЬЃК____ЁЃ
(4)БэжаФГСНжждЊЫиЕФЦјЬЌЕЅжЪПЩвдаЮГЩШМСЯЕчГиЃЌЦфВњЮяЧхНрЮоЮлШОЃЌЧыаДГіМюадЛЗОГжаИКМЋЗДгІЪН____ЁЃ
ЁОД№АИЁПЕЊ ЕкШ§жмЦкЕкЂїAзх Al2O3ЃЋ2OHЃ=2AlO2-ЃЋH2O ![]()
![]() H2-2e-+2OH-= 2H2O(Лђ 2H2-4e-+4OH-=4H2O )
H2-2e-+2OH-= 2H2O(Лђ 2H2-4e-+4OH-=4H2O )
ЁОНтЮіЁП
гЩдЊЫидкжмЦкБэжаЕФЮЛжУПЩжЊЃЌAЮЊЧтдЊЫиЃЌBЮЊЬМдЊЫиЃЌCЮЊЕЊдЊЫиЃЌDЮЊбѕдЊЫиЃЌEЮЊЗњдЊЫиЃЌFЮЊФЦдЊЫиЃЌGЮЊТСдЊЫиЃЌHЮЊЙшдЊЫиЃЌIЮЊТШдЊЫиЁЃ
(1)ЭЌжмЦкздзѓЖјгвЃЌЗЧН№ЪєаддіЧПЃЌЫљвдЗЧН№ЪєNЃОCЃЛIДІгкЕкШ§ааЃЌЕк17СаЃЌЮЊClдЊЫиЃЌДІгкжмЦкБэжаЕкШ§жмЦкЃЌЕкVIIAзхЃЛ
(2)ИУдЊЫиЮЊТСдЊЫиЃЌПЩаЮГЩСНадбѕЛЏЮяAl2O3ЃЌбѕЛЏТСгыЧтбѕЛЏФЦЗДгІЩњГЩЦЋТСЫсФЦгыЫЎЃЌРызгЗНГЬЪНЮЊAl2O3ЃЋ2OHЃ=2AlO2-ЃЋH2OЃЛ
(3)ИУдЊЫиЕФЕЅжЪдкГЃЮТЯТЮЊЦјЬЌЃЌдђЮЊHЁЂNЁЂOЁЂFЁЂClжаЕФвЛжжЃЌЦфжаФмгыAЁЋIЙЙГЩдзгИіЪ§БШЮЊ1ЁУ1КЭ1ЁУ2ЕФСНжжЙВМлЛЏКЯЮяЕФдЊЫижЛгаOЃЌдђXЮЊH2O2ЃЌYЮЊH2OЃЌЫЎЮЊЙВМлЛЏКЯЮяЃЌЕчзгЪНЮЊ![]() ЃЛФмгыNaаЮГЩРызгЛЏКЯЮяNa2O2КЭNa2OЃЌМДMЮЊNa2OЃЌЦфаЮГЩЙ§ГЬЮЊЃК
ЃЛФмгыNaаЮГЩРызгЛЏКЯЮяNa2O2КЭNa2OЃЌМДMЮЊNa2OЃЌЦфаЮГЩЙ§ГЬЮЊЃК![]() ЃЛ
ЃЛ
(4)ЧтЦјКЭбѕЦјПЩвдаЮГЩЧтбѕШМСЯЕчГиЃЌдЕчГижаИКМЋЗЂЩњбѕЛЏЗДгІЃЌЫљвдЧтЦјдкИКМЋЕУЕчзгЃЌгЩгкЕчНтжЪШмвКЮЊМюадЃЌЫљвдЩњГЩЫЎЃЌЕчМЋЗНГЬЪНЮЊЃКH2-2e-+2OH-= 2H2O(Лђ2H2-4e-+4OH-=4H2O)ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљОнвЊЧѓЛиД№ЯТСаЮЪЬтЃК
ЂйИЩБљгыCO2ЃЛ ЂкАзСзгыКьСзЃЛ Ђл![]() Clгы
Clгы![]() ClЃЛ
ClЃЛ
ЂмвКТШгыТШЫЎЃЛ Ђн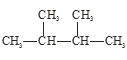 гы
гы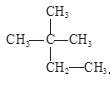 ЁЃ
ЁЃ
дкЩЯЪіИїзщЮяжЪжаЃК
(1)ЛЅЮЊЭЌЮЛЫиЕФЪЧ_____________ЃЛ
(2)ЛЅЮЊЭЌЫивьаЮЬхЕФЪЧ__________ЃЌ
(3)ЛЅЮЊЭЌЗжвьЙЙЬхЕФЪЧ_________ЃЛ
(4)ЪєгкЭЌжжЮяжЪЕФЪЧ_________ЁЃЃЈЬюађКХЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКX(g)+2Y(g)![]() 3Z(g) ЁїH=Ѓa kJ.molЃ1(a>0)ЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
3Z(g) ЁїH=Ѓa kJ.molЃ1(a>0)ЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. Щ§ИпЗДгІЮТЖШЃЌФцЗДгІЫйТЪдіДѓЃЌе§ЗДгІЫйТЪдіДѓ
B. ДяЕНЛЏбЇЦНКтзДЬЌЪБЃЌXЁЂYЁЂZЕФжЪСПВЛдйЗЂЩњБфЛЏ
C. ДяЕНЛЏбЇЦНКтзДЬЌЪБЃЌЗДгІЗХГіЕФзмШШСППЩДяakJ
D. XКЭYГфЗжЗДгІЩњГЩZЕФЮяжЪЕФСПВЛПЩФмДяЕН3 mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃЙигкГЃЮТЯТpH=2ЕФH2C2O4ШмвКЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. 1LШмвКжаЕФH+Ъ§ФПЮЊ0.02NA
B. МгШыNaHC2O4ЙЬЬхЃЌШмвКЫсаддіЧП
C. cЃЈH+ЃЉ-cЃЈOH-ЃЉ=cЃЈHC2O4-ЃЉ+2cЃЈC2O42-ЃЉ
D. МгЫЎЯЁЪЭЃЌШмвКжаЫљгаРызгХЈЖШОљМѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїЮяжЪЪЧжабЇЛЏбЇжаГЃМћЕФЮяжЪЃЌМзЮЊГЃМћН№ЪєЕЅжЪЃЌБћЮЊЛЦТЬЩЋЕФЕЅжЪЦјЬхЃЌввЁЂЖЁЪЧГЃМћЮоЩЋЦјЬЌЗЧН№ЪєЕЅжЪЃЌЦфЫќОљЮЊЛЏКЯЮяЃЌCГЃЮТЯТЮЊвЛжжвКЬхЃЌBЁЂDЗжБ№ЮЊКкЩЋЗлФЉКЭКкЩЋОЇЬхЃЌGЮЊЕЛЦЩЋЙЬЬхЃЌJЮЊЩњЛюжаГЃМћЕФЕїЮЖЦЗЃЌIЮЊКьКжЩЋЙЬЬхЃЌFЮЊзиЛЦЩЋШмвКЁЃЂйЪЧЪЕбщЪвжЦШЁЖЁЕФЗДгІжЎвЛЁЃИїЮяжЪМфЕФзЊЛЏШчЯТЭМЫљЪОЃЌЛиД№ЯТСаЮЪЬт(ВПЗжЩњГЩЮяЮДСаГі)ЃК

(1)ЮяжЪIЕФЛЏбЇЪНЮЊ________ЃЛFжавѕРызгЪЧ______________ЃЛ
(2)ЗДгІЂйЕФЛЏбЇЗНГЬЪНЮЊЮЊ____________ЃЛ
(3)BгыKЕФЗДгІЪЧЪЕбщЪвжЦШЁБћЕФЗДгІЃЌЦфРызгЗНГЬЪНЮЊ____________ЃЛ
(4)ЗДгІЂкЕФЛЏбЇЗНГЬЪНЮЊ_____________ЃЛ
(5)ШєEгыGвдЮяжЪЕФСПБШЮЊ1:1ЭЖШызуСПЫЎжаЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________ЃЛЩњГЩ1molЦјЬхзЊвЦЕчзгЕФИіЪ§ЮЊ__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИпЬњЫсМиЃЈK2FeO4ЃЉЪЧвЛжжаТаЭЁЂИпаЇЁЂЖрЙІФмТЬЩЋЫЎДІРэМСЃЌБШCl2ЁЂO2ЁЂClO2ЁЂKMnO4бѕЛЏадИќЧПЃЌЮоЖўДЮЮлШОЃЌЙЄвЕЩЯЪЧЯШжЦЕУИпЬњЫсФЦЃЌШЛКѓдкЕЭЮТЯТЃЌЯђИпЬњЫсФЦШмвКжаМгШыKOHжСБЅКЭЃЌЪЙИпЬњЫсМиЮіГіЁЃ
ЃЈ1ЃЉИЩЗЈжЦБИИпЬњЫсФЦЕФжївЊЗДгІЮЊ2FeSO4+6Na2O2ЈT2Na2FeO4+2Na2O+2Na2SO4+O2ЁќЃЌИУЗДгІжаЕФЛЙдМСЪЧ____ЃЌУПЩњГЩl mol Na2FeO4зЊвЦ__molЕчзгЁЃ
ЃЈ2ЃЉЪЊЗЈжЦБИИпЬњЫсМиЃЈK2FeO4ЃЉЕФЗДгІЬхЯЕжагаСљжжЮЂСЃЃКFeЃЈOHЃЉ3ЁЂClOЉЁЂOHЉЁЂFeO42ЉЁЂClЉЁЂH2OЁЃ
ЂйаДГіВЂХфЦНЪЊЗЈжЦИпЬњЫсМиЕФРызгЗДгІЗНГЬЪНЃК________ЁЃ
ЂкШєЗДгІЙ§ГЬжазЊвЦСЫ0.3molЕчзгЃЌдђЛЙдВњЮяЕФЮяжЪЕФСПЮЊ______molЁЃ
ЃЈ3ЃЉНЋSO2ЭЈШыКЌ1molТШЫсЕФШмвКжаЃЌПЩЩњГЩвЛжжЧПЫсКЭвЛжжбѕЛЏЮяЃЌВЂга6.02ЁС1023ИіЕчзгзЊвЦЃЌдђИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГШмвКПЩФмКЌгаClЁЅЁЂSO42ЁЅЁЂCO32ЁЅЁЂNH4+ЁЂFe3+ЁЂFe2+ЁЂAl3+ КЭNa+ЁЃФГЭЌбЇЮЊСЫШЗШЯЦфГЩЗжЃЌШЁВПЗжЪдвКЃЌЩшМЦВЂЭъГЩСЫШчЯТЪЕбщЃК

гЩДЫПЩжЊдШмвКжа
AЃЎдШмвКжаcЃЈFe3+ЃЉ=0.2 molЁЄL-1
BЃЎШмвКжажСЩйга4жжРызгДцдкЃЌЦфжаClЁЅвЛЖЈДцдкЃЌЧвcЃЈClЁЅЃЉЁн0.2 molЁЄL-1
CЃЎSO42ЁЅЁЂNH4+ ЁЂNa+вЛЖЈДцдкЃЌCO32ЁЅЁЂAl3+вЛЖЈВЛДцдк
DЃЎвЊШЗЖЈдШмвКжаЪЧЗёКЌгаFe2+,ЦфВйзїЮЊЃКШЁЩйСПдШмвКгкЪдЙмжа,МгШыЪЪСПТШЫЎЃЌЮоЯжЯѓЃЌдйМгKSCNШмвКЃЌШмвКГЩбЊКьЩЋЃЌдђКЌгаFe2+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШМСЯЕчГиЪЧФПЧАЕчГибаОПЕФШШЕужЎвЛЁЃФГПЮЭтаЁзщзджЦЕФЧтбѕШМСЯЕчГиШчЭМЫљЪОЃЌaЁЂbОљЮЊЖшадЕчМЋЯТСаа№ЪіВЛе§ШЗЕФЪЧ( )
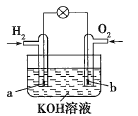
A.aМЋЪЧИКМЋЃЌИУЕчМЋЩЯЗЂЩњбѕЛЏЗДгІ
B.bМЋЗЂЩњЕФЕчМЋЗДгІЪЧO2+4OH--4e-=2H2O
C.ЕчГизмЗДгІЗНГЬЪНЮЊ2H2+O2=2H2O
D.ЧтбѕШМСЯЕчГиЪЧвЛжжОпгагІгУЧАОАЕФТЬЩЋЕчдД
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкШчЭМдЕчГиЕФа№ЪіДэЮѓЕФЪЧЃЈ ЃЉ

A.ЕчГиЙЄзїЪБЃЌЕчСїгЩ a СїЯђ b
B.ЮЂЩњЮяЫљдкЕчМЋЧјЗХЕчЪБЗЂЩњбѕЛЏЗДгІ
C.ЗХЕчЙ§ГЬжаЃЌHЃЋДге§МЋЧјвЦЯђИКМЋЧј
D.е§МЋЗДгІЪНЮЊЃКMnO2ЃЋ4HЃЋЃЋ2eЃ=Mn2ЃЋЃЋ2H2O
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com