
暗紫色化合物A具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 ;化合物A与H2O反应的离子方程式为 。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是 。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是
| A.亚硫酸钠 | B.KOH | C.醋酸 | D.Fe(NO3)3 |
(1)K2FeO4 4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-
(2)+6价的铁具有强氧化性可以杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体净水
(3)3KClO+4KOH+2Fe(OH)3=2K2FeO4+3KCl+5H2O (4)B;
(5)取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢
解析试题分析:(1)根据题意可知:该化合物与水发生反应产生的红褐色的沉淀为Fe(OH)3,气体为O2,红棕色粉末是 Fe2O3n(Fe2O3)="m/M=" 1.60g÷160g=" 0.01mol" , n(Fe) ="0.02mol.," 滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐是K2SO4,质量为10.44g。n(K2SO4)=1044g÷174g/mol=0.06mol,所以原固体中含有的K+的物质的量为0.06×2-0.08=0.04mol,m(O)=" 3.96g" -0.02mol×56g/mol- 0.04mol× 39g/mol= 1.28g,所以n(O)=1.28g÷16g/mol=0.08mol.因此在化合物A中个元素的个数比为K:Fe:O=0.04:0.02:0.08=2:1:4.故化学式为K2FeO4。它与水反应的化学方程式为:4K2FeO4+10H2O=4Fe(OH)3↓+3O2↑+8KOH。 离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-。(2)K2FeO4还可作为一种“绿色高效多功能”水处理剂。原因是FeO42-中的Fe元素的化合价为+6价,有强的氧化性,可以起到杀菌消毒的作用,其还原产物为Fe3+,水解产生氢氧化铁胶体表面积大,吸附力强,能够吸附水中的固体颗粒使之转化为沉淀而达到净化水的作用。(3)在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式3KClO+4KOH+ 2Fe(OH)3= 2K2FeO4+3KCl+5H2O。(4)因为在水溶液在发生离子反应 4FeO42-+10H2O =4Fe(OH)3↓+3O2↑+8OH-,所以要提高其稳定性,应该使溶液显碱性。亚硫酸钠 、KOH呈碱性,但考虑到亚硫酸钠有还原性,K2FeO4有强氧化性,二者会发生氧化还原反应而不能共存,因此有可能提高化合物A水溶液稳定性的物质只能是KOH。(5)为研究温度对化合物A水溶液稳定性的影响实验方案是取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢。
考点:考查K2FeO4的组成、结构、性质及用途的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: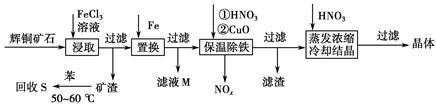
(1)写出浸取过程中Cu2S溶解的离子方程式___________________________。
(2)回收S过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是____________________、____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为______________________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是____________________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
100ml 2mol/LNaOH溶液中通入一定量的CO2,反应后溶液中Na2CO3和NaHCO3的物质的量浓度之比为1∶2。则:
(1)写出其中生成Na2CO3的反应的离子方程式: 。
(2)生成碳酸氢钠的物质的量为 mol。
(3)若往原NaOH溶液中通入标准状况下的CO2气体1.12L后,再逐滴滴加0.5mol/L的盐酸,至少加入 ml后才会有CO2气体放出(不考虑CO2溶解在水中)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
则镁铝合金中加NaOH溶液的化学反应方程式为 ,金属X是 ,
固体A的化学式 ,操作②包含的步骤有蒸发浓缩、 、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称 ,需要测定的数据有 。(已知该实验时的温度压强)
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为 mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。 
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按下图进行实验: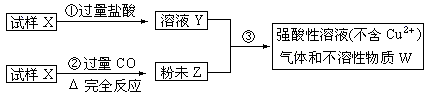
(1)请写出步聚③中发生的全部反应的离子方程式:____________________________________。
(2)要使试样X转变为粉末Z。除了CO外,还可以使用 。
| A.氢气 | B.焦炭 | C.氯气 | D.氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
识图绘图是重要的技能。按要求回答下列问题:
(1)向碳酸钠溶液中,逐滴加入盐酸,生成气体的物质的量与加入盐酸体积如甲图所示,则OA段发生反应的离子方程式为________,AB段发生反应的离子方程式为________。
(2)在乙图中补充向澄清石灰水中通入CO2,生成沉淀质量与CO2体积的关系图。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁和铝是生产和生活中最常见的两种金属,其单质和化合物被广泛应用。
(1)硫酸铁溶液可用于浸出黄铜矿精矿,其主要反应为:
CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为-2价,Fe为+2价)。
关于该反应,下列说法中,正确的是 (选填序号);
a.从物质分类的角度看,CuFeS2属于合金 b.反应过程中只有一种元素被还原
c.CuFeS2既作氧化剂又作还原剂 d.当转移1 mol电子时,产生16 g S
(2)高铁酸钾(K2FeO4)是一种新型水处理剂,在水中发生反应生成Fe(OH)3胶体。该反应中,高铁酸钾表现 (填“氧化性”或“还原性”),Fe(OH)3胶体具有净水作用,其原因是 。
(3)某同学取一张铝箔,并用针刺一些小孔,然后取一药匙过氧化钠粉末,用铝箔包好,放入右图所示装置内倒扣的漏斗中(图中铁架台和铁夹没有画出)。
按顺序写出该过程中发生反应的离子方程式:
① ;
② 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
已知NaHCO3在低温下溶解度较小。
反应Ⅰ:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 ___________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。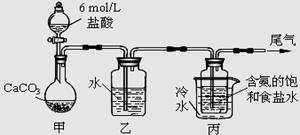
(1)装置丙中冷水的作用是 ;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 ;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。
则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是 ; 21
(4)若取21.0 g NaHCO3固体,加热了t2 rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol?L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据下列转化关系以及现象回答: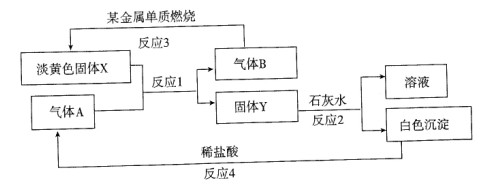
(1)固体X的名称是 ,Y的化学式是 。
(2)写出反应l的化学方程式 。
(3)写出反应2的化学方程式 。
(4)若15.6g X和足量水反应,转移 mol e-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com