
| O | 2- 4 |
| O | 2- 4 |
| O | 2- 4 |
| 1 |
| 2 |
| 1.1×10-10 |
| 0.01 |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| A、1L0.1mol?L-1 Na2CO3溶液中有NA个CO32- |
| B、常温常压下,22gCO2中共有2NA个共用电子对 |
| C、0.1mol Na2O2与水完全反应,转移的电子数为0.2NA |
| D、2.8gN2、CO和C2H4组成的混合气体所占有的体积约为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
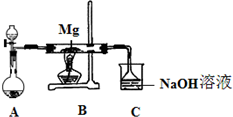 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
| ||
| ||
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所得固体于试管中 | |
| ② | 向试管中的固体慢慢滴加 试管口塞上带导管的单孔塞,并将导管通入盛有 |
若试管中的 则丙同学推测正确. 若试管中的固体未完全溶解,且 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com