
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)

请回答下列问题:
(1)A的化学式为_____________,丙的化学式为_____________;
(2)写出下列反应的离子方程式:
① _________________________________________;
④_________________________________________;
⑤_________________________________________。
(3)写出C溶液与Al反应的化学方程式____________________。
(4)请写出物质C和物质E反应生成的难溶产物在空气中加热发生的化学反应。_________________;______________;
(5)为鉴定B单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____。
A. 碘水 B. NaOH溶液 C. KSCN溶液 D. Na2SO3溶液
【答案】Na HCl 2Na+2H2O=2Na++2OH-+H2↑ 2Fe2++Cl2=2Fe3++2Cl- Fe3++3OH-=Fe(OH)3↓ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 4Fe(OH)2+O2+H2O= Fe(OH)3 2Fe(OH)3 ![]() Fe2O3 +3 H2O B
Fe2O3 +3 H2O B
【解析】
金属单质A的焰色反应为黄色,则A是Na,黄绿色气体乙是Cl2,Na和水反应生成NaOH和H2,则气体甲是H2、物质C是NaOH,氢气和氯气反应生成HCl,所以丙是HCl,D是盐酸,D和金属B反应生成物质E,E能被氯气氧化生成F,F和NaOH反应生成红褐色沉淀,则红褐色沉淀是Fe(OH)3,所以F是FeCl3、E是FeCl2、B是Fe,结合物质的性质分析解答。
根据上述分析,金属单质A是Na,B是Fe,气体乙是Cl2,气体甲是H2、物质C是NaOH,丙是HCl,D是盐酸,E是FeCl2,F是FeCl3。
(1)通过以上分析知,A是Na,C是HCl,故答案为:Na;HCl;
(2)反应①为Na和水反应生成NaOH和H2,离子反应方程式为:2Na+2H2O=2Na++2OH-+H2↑;反应④为氯化亚铁和氯气反应生成氯化铁,离子反应方程式为Cl2+2Fe2+=2Fe3++2Cl-;反应⑤为氯化铁和氢氧化钠反应生成氢氧化铁,离子方程式为Fe3++3OH-═Fe(OH)3↓,故答案为:2Na+2H2O=2Na++2OH-+H2↑;Cl2+2Fe2+=2Fe3++2Cl-;Fe3++3OH-═Fe(OH)3↓;
(3)铝能溶于氢氧化钠溶液生成偏铝酸钠和氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)氯化亚铁与氢氧化钠反应生成白色氢氧化亚铁沉淀,氢氧化亚铁容易被空气中的氧气氧化生成氢氧化铁,氢氧化铁受热容易分解,反应的化学方程式为4Fe(OH)2+O2+H2O= Fe(OH)3、2Fe(OH)3 ![]() Fe2O3 +3 H2O,故答案为:4Fe(OH)2+O2+H2O= Fe(OH)3;2Fe(OH)3
Fe2O3 +3 H2O,故答案为:4Fe(OH)2+O2+H2O= Fe(OH)3;2Fe(OH)3 ![]() Fe2O3 +3 H2O;
Fe2O3 +3 H2O;
(5)亚铁离子能被氯气氧化生成铁离子,铁离子能和KSCN溶液反应生成血红色溶液,所以可以用氯水、KSCN检验,也可以用氢氧化钠检验,根据现象:生成白色沉淀,迅速变成灰绿色,最终变成红褐色判断,故答案为:B。


科目:高中化学 来源: 题型:
【题目】根据要求结合化学用语解释下列问题:
(1)NaHCO3溶液呈碱性的原因:__________________
(2)可用CuO除去CuCl2溶液中的FeCl3溶液的原因:_________________
(3)水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去,请分析转化原理:_________________
(4)将密封的NO2气体加热,气体颜色变深的原因:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X溶液中加入Y试剂,产生沉淀或气体如图,与所述情形几乎完全相符的是( )

A. 向HCl和AlCl3的混合液滴加NaOH溶液 B. 向NH4Al(SO4)2 溶液滴加 Ba(OH)2溶液
C. 向NaOH和Ca(OH)2混合液中通入CO2 D. 向NaOH和Na2CO3混合液滴加稀HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组探究实验室中制备Cl2的过程,为证明过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如下图所示的实验装置,按要求回答问题。
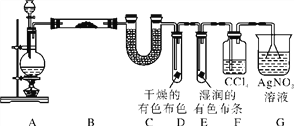
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是________________________。
(2)①装置B中盛放的试剂名称为_______,作用是___________,现象是___________。
②装置D和E中出现的不同现象说明的问题是_______________________________。
③装置F的作用是____________________。
④写出装置G中发生反应的离子方程式:__________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应加入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源;乙是利用装置甲模拟工业电解法来处理含Cr2O72-废水,电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。当电池工作时,下列说法错误的是

A. 甲中H+透过质子交换膜由左向右移动
B. 乙池中Fe棒应与甲池中的M极相连
C. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
D. 若溶液中减少了0.OlmolCr2O72-,则电路中至少转移了0.06 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列问题,与盐类水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂
②NaHCO3与Al2(SO4)3两种溶液用于制造泡沫灭火器
③将含有CaSO4的水垢用Na2 CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②⑤ B. ②③④ C. ①②④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的俗名与化学式对应正确的是
A. 苏打——NaHCO3B. 明矾——Al2(SO4)3
C. 干冰——CO2D. 生石灰——Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于金属钠的叙述中正确的是( )
A.金属钠可保存在煤油中
B.金属钠可将铁从其盐溶液中置换出来
C.钠投入水中立即熔化成小球,说明钠的熔点低,且钠与水反应为吸热反应
D.钠在空气中能发生缓慢氧化而发生自燃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com