
【题目】根据要求结合化学用语解释下列问题:
(1)NaHCO3溶液呈碱性的原因:__________________
(2)可用CuO除去CuCl2溶液中的FeCl3溶液的原因:_________________
(3)水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去,请分析转化原理:_________________
(4)将密封的NO2气体加热,气体颜色变深的原因:______________________
【答案】 HCO3-既会电离也会水解,且电离程度小于水解程度,HCO3-![]() H++CO32-,HCO3-+H2O
H++CO32-,HCO3-+H2O![]() OH-+H2CO3 FeCl3溶液存在:Fe3+ +3H2O
OH-+H2CO3 FeCl3溶液存在:Fe3+ +3H2O![]() Fe(OH)3 +3H+,加入CuO与H+反应:CuO+2H+=Cu2++H2O,促进Fe3+水解,使Fe3+转化为Fe(OH)3,过滤除去 CaSO4存在平衡:CaSO4
Fe(OH)3 +3H+,加入CuO与H+反应:CuO+2H+=Cu2++H2O,促进Fe3+水解,使Fe3+转化为Fe(OH)3,过滤除去 CaSO4存在平衡:CaSO4![]() Ca2+ +SO42-,加入Na2CO3溶液,CO32-结合Ca2+生成CaCO3,促使平衡右移,CaSO4转化CaCO3 NO2存在平衡2NO2
Ca2+ +SO42-,加入Na2CO3溶液,CO32-结合Ca2+生成CaCO3,促使平衡右移,CaSO4转化CaCO3 NO2存在平衡2NO2![]() N2O4,加热后平衡左移,NO2浓度增加,颜色变深
N2O4,加热后平衡左移,NO2浓度增加,颜色变深
【解析】(1)HCO3-既会电离也会水解,HCO3-![]() H++CO32-,HCO3-+H2O
H++CO32-,HCO3-+H2O![]() OH-+H2CO3,且电离程度小于水解程度,因此溶液显碱性,故答案为:HCO3-既会电离也会水解,HCO3-
OH-+H2CO3,且电离程度小于水解程度,因此溶液显碱性,故答案为:HCO3-既会电离也会水解,HCO3-![]() H++CO32-,HCO3-+H2O
H++CO32-,HCO3-+H2O![]() OH-+H2CO3,且电离程度小于水解程度;
OH-+H2CO3,且电离程度小于水解程度;
(2)FeCl3溶液存在:Fe3+ +3H2O![]() Fe(OH)3 +3 H+,加入CuO与H+反应:CuO+2H+=Cu2++H2O,促进Fe3+水解,使Fe3+转化为Fe(OH)3沉淀,然后过滤除去,故答案为:FeCl3溶液存在:Fe3+ +3H2O
Fe(OH)3 +3 H+,加入CuO与H+反应:CuO+2H+=Cu2++H2O,促进Fe3+水解,使Fe3+转化为Fe(OH)3沉淀,然后过滤除去,故答案为:FeCl3溶液存在:Fe3+ +3H2O![]() Fe(OH)3 +3 H+,加入CuO与H+反应:CuO+2H+=Cu2++H2O,促进Fe3+水解,使Fe3+转化为Fe(OH)3沉淀;
Fe(OH)3 +3 H+,加入CuO与H+反应:CuO+2H+=Cu2++H2O,促进Fe3+水解,使Fe3+转化为Fe(OH)3沉淀;
(3)CaSO4存在溶解平衡:CaSO4![]() Ca2+ +SO42-,加入Na2CO3溶液,CO32-结合Ca2+生成CaCO3,促使平衡右移,CaSO4转化CaCO3,因此水垢中的CaSO4,可用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去,故答案为:CaSO4存在溶解平衡:CaSO4
Ca2+ +SO42-,加入Na2CO3溶液,CO32-结合Ca2+生成CaCO3,促使平衡右移,CaSO4转化CaCO3,因此水垢中的CaSO4,可用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去,故答案为:CaSO4存在溶解平衡:CaSO4![]() Caspan>2+ +SO42-,加入Na2CO3溶液,CO32-结合Ca2+生成CaCO3,促使平衡右移,CaSO4转化CaCO3;
Caspan>2+ +SO42-,加入Na2CO3溶液,CO32-结合Ca2+生成CaCO3,促使平衡右移,CaSO4转化CaCO3;
(4)2NO2N2O4 △H<0,N2O4无色,加热平衡逆向移动,NO2浓度增加,气体颜色变深,故答案为:NO2存在平衡2NO2![]() N2O4,加热后平衡左移,NO2浓度增加,颜色变深。
N2O4,加热后平衡左移,NO2浓度增加,颜色变深。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液,在强酸性或强碱性溶液中都能大量共存且无色的离子组( )
A.K+、Cu2+、CO32-、NH4+B.Ba2+、Na+、SO42-、NO3-
C.K+、Na+、HCO3-、Cl-D.K+、Na+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法错误的是( )

A. a点所示溶液中c(Na+)>c(A—) >c(HA)>c(H+)
B. 水的电离程度: a点>b点
C. pH=7时,c(Na+)= c(A—)+ c(HA)
D. b点所示溶液中c(A—)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是
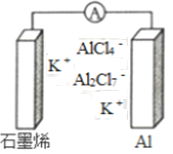
A. 放电时,Cn(石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一定量的铁与足量的稀硫酸及足量的CuO制单质铜,有人设计了以下两种方案:
①Fe![]() H2
H2![]() Cu ②CuO
Cu ②CuO![]() CuSO4
CuSO4![]() Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量为
A. 一样多 B. ①多 C. ②多 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在测定1mol气体体积的实验中,若镁条中含有不与稀硫酸反应的杂质,其他步骤均无误差,则测定结果会
A. 偏大B. 偏小C. 不影响D. 都有可能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)

请回答下列问题:
(1)A的化学式为_____________,丙的化学式为_____________;
(2)写出下列反应的离子方程式:
① _________________________________________;
④_________________________________________;
⑤_________________________________________。
(3)写出C溶液与Al反应的化学方程式____________________。
(4)请写出物质C和物质E反应生成的难溶产物在空气中加热发生的化学反应。_________________;______________;
(5)为鉴定B单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____。
A. 碘水 B. NaOH溶液 C. KSCN溶液 D. Na2SO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com