
【题目】下列说法正确的是
A. 3.0L0.1mol·L-1NaOH溶液中缓慢通入CO2至溶液增重8.8g时。溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B. 常温下,将CH3COONa溶液和盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-)
C. 常温下,pH=6的NaHSO3溶液中:c(SO32-)- c(H2SO3)=9.9×10-7mol·L-1
D. Ksp (Fe(OH)3)=1.0×10-38,Ksp (Mg(OH)2)=1.0×10-11,则浓度均为0.1 mol·L-1氯化铁、氯化镁混合溶液,若除去溶液中的Fe3+,应将pH调至3~11。
【答案】C
【解析】A.3.0L0.1mol·L-1NaOH溶液含有0.3molNaOH,缓慢通入CO2至溶液增重8.8g时通入CO20.2mol,3NaOH+2CO2![]() NaHCO3+Na2CO3+H2O,Na2CO3的水解程度大于NaHCO3,所以溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故A错误;B. 常温下,将CH3COONa溶液和盐酸混合,CH3COONa+HCl
NaHCO3+Na2CO3+H2O,Na2CO3的水解程度大于NaHCO3,所以溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故A错误;B. 常温下,将CH3COONa溶液和盐酸混合,CH3COONa+HCl![]() CH3COOH+NaCl,若c(CH3COONa)=c(CH3COOH),则溶液呈酸性,当溶液pH=7时,c(CH3COONa)>c(CH3COOH)=c(NaCl),而且水解消耗的CH3COONa与电离消耗的CH3COOH 的物质的量相等,因此,c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-),故B错误;C. 常温下,pH=6的NaHSO4溶液中,电荷守恒:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),元素守恒:c(Na+)=c(HSO3-)+c(SO32-)+ c(H2SO3),两个表达式消去c(Na+)得c(SO32-)- c(H2SO3)=c(H+)-c(OH-)=1.0×10-6mol·L-1-1.0×10-8mol·L-1=9.9×10-7mol·L-1,故C正确;D. Ksp (Fe(OH)3)=1.0×10-38,Ksp (Mg(OH)2)=1.0×10-11,则浓度均为0.1 mol·L-1氯化铁、氯化镁混合溶液,若除去溶液中的Fe3+,应控制c(Fe3+ )< 10-5mol/L,c(OH-)>(
CH3COOH+NaCl,若c(CH3COONa)=c(CH3COOH),则溶液呈酸性,当溶液pH=7时,c(CH3COONa)>c(CH3COOH)=c(NaCl),而且水解消耗的CH3COONa与电离消耗的CH3COOH 的物质的量相等,因此,c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-),故B错误;C. 常温下,pH=6的NaHSO4溶液中,电荷守恒:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),元素守恒:c(Na+)=c(HSO3-)+c(SO32-)+ c(H2SO3),两个表达式消去c(Na+)得c(SO32-)- c(H2SO3)=c(H+)-c(OH-)=1.0×10-6mol·L-1-1.0×10-8mol·L-1=9.9×10-7mol·L-1,故C正确;D. Ksp (Fe(OH)3)=1.0×10-38,Ksp (Mg(OH)2)=1.0×10-11,则浓度均为0.1 mol·L-1氯化铁、氯化镁混合溶液,若除去溶液中的Fe3+,应控制c(Fe3+ )< 10-5mol/L,c(OH-)>(  =10-11mol/L,pH=3,Mg2+不沉淀应控制c(OH-)<
=10-11mol/L,pH=3,Mg2+不沉淀应控制c(OH-)<  =1×10-5mol/L,pH=9,总之,应将pH调至3~9,故D错误。故选C。
=1×10-5mol/L,pH=9,总之,应将pH调至3~9,故D错误。故选C。


科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.氧化还原反应的本质是元素化合价发生了变化
B.所含元素化合价升高的反应物被氧化
C.得到电子的物质被氧化
D.氧化还原反应中,氧化剂和还原剂一定是两种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法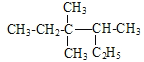 的名称为3,3-二甲基-2-乙基戊烷
的名称为3,3-二甲基-2-乙基戊烷
B. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
C. 分子式为C5H12O的醇共有8 种,其中能催化氧化成醛的同分异构体有3 种
D. 乙烯和苯均能使溴水因发生化学反应褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H++OH-向右移动且溶液呈酸性的是
H++OH-向右移动且溶液呈酸性的是
A. 向水中加入NaHSO4溶液 B. 将水加热到100℃,使pH=6
C. 向水中加入Na2CO3溶液 D. 向水中加入Al2(SO4)3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并检验氯气的氧化性,同时用电解产生的H2还原CuO粉末来测定Cu的相对原子质量。

(1)写出电解饱和食盐水的离子方程式_________________________________。
(2)为完成上述实验,正确的连接顺序为A连_______;B连_______ (填写导管口字母)。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是下列试剂中的___________。
a.酸性高锰酸钾溶液 b.淀粉碘化钾溶液 c.亚硫酸钠溶液 d.氯化亚铁溶液
(4)丙装置的c瓶中盛放的试剂为___________,作用是______________________。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定U型管b反应前后的质量变化,得到生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:___________方案所测结果更准确。若按合理方案测定的数据计算,Cu的相对原子质量为________________。
②不合理的方案会造成测定结果___________(填“偏低、偏高或无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的使用,下列操作不正确的是( )
A.容量瓶是不能作为反应容器或长期贮存溶液的容器
B.用蒸馏水洗涤后不需要将容量瓶烘干
C.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行
D.为了使所配溶液浓度均匀,定容结束后,要摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”的电化学实验装置如图所示。该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法错误的是

A. 该装置工作时,H+从b极区向a极区迁移
B. a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O
C. 每生成1molO2,有44gCO2被还原
D. C3H8O形成燃料电池以氢氧化钠作为电解质溶液的负极反应式:C3H8O-18e-+24OH-=3CO32-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组模拟工业上海水提溴,设计如下实验。 回答下列问题:
Ⅰ. 利用如图所示装置富集溴:
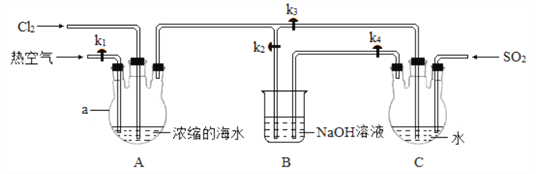
实验步骤:
①关闭 k1、k3,打开k2,向装置A 中通入足量Cl2,充分反应;
②停止通Cl2,关闭k2,打开 k1、k3 和k4, 向装置A 中通入足量热空气,同时向装置C中通入足量SO2,充分反应;
③停止通气体,关闭k1、k4。
(1)a 的名称为___________。
(2) 步骤①中主要反应的离子方程式为_____________。
(3) 步骤②中通入热空气的作用为_______。 装置 C 发生富集溴的反应中,氧化剂与还原剂的物质的量之比为____________;实际参加反应的SO2 的物质的量大于理论值,主要原因为_____________(用化学方程式表示)。
Ⅱ.制备溴:
富集溴的过程结束后,继续向装置 C 中通入 Cl2,充分反应后蒸馏。
(4)下列蒸馏装置正确的是_____(填选项字母)。

(5) 装置 A 中加入V mL 含 Br-的浓度为 c mol·L-1的浓缩海水,蒸馏所得溴单质的质量为 m g, 则该实验中溴单质的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题:
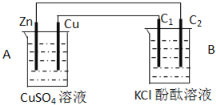
(1)判断装置的名称:A池为_________,B池为___________。
(2)铜极为______极,电极反应式为_________,石墨棒C1为___极,电极反应式为______________________,石墨棒C2附近发生的实验现象为___________________。
(3)当C2极析出224mL气体(标准状态时),锌的质量变化(增加或减少)_____g,CuSO4溶液的质量变化了(增加或减少了)______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com