
【题目】X.Y、Z、W四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
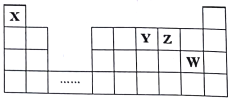
A. 四种元素的原子半径由小到大的顺序为:r(X)<r(Z)<r(W)<r(Y)
B. X、Y、Z既能形成离子化合物,又能形成共价化合物
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有2种
D. H2Z的熔点比HW高,是因为它们的晶体类型不同
科目:高中化学 来源: 题型:
【题目】我国成功研制的一种新型可充放电 AGDIB 电池(铝-石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为 CxPF6+LiyAl=Cx+LiPF6+Liy-1+Al。放电过程如图,下列说法正确的是
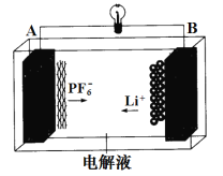
A. B为负极,放电时铝失电子
B. 电解液可以用常规锂盐和水代替
C. 充电时 A 电极反应式为 Cx + PF6- - e-= CxPF6
D. 废旧 AGDIB 电池进行“放电处理”时,若转移 1mol 电子,石墨电极上可回收 7gLi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C. 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D. 凡是化合反应都是放热反应,分解反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是
A. Na与水反应时增大水的用量
B. 将锌与稀硫酸反应时,向溶液中加入少量CuSO4晶体
C. Fe与稀硫酸反应制取氢气时,改用浓硫酸
D. 用碳还原Fe2O3冶炼铁时,增大碳的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 同温同压下,相同体积的气体,其分子数一定相等,原子数也一定相等
B. 任何条件下,等物质的量的甲烷(CH4)和一氧化碳,体积一定相同
C. 同温同压下的一氧化碳气体和氮气,若体积相等,则质量一定相等
D. 从1 L 0.5 mol·L-1 NaCl溶液中取出100 mL,剩余溶液中NaCl物质的量浓度为0.45 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL-1) | V/mL | c/(molL-1) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣(主要成分为Ca(OH)2和CaCO3)为原料制备KClO3的流程如下:
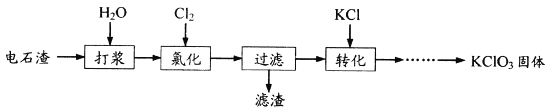
下列说法不正确的是
A. 氯化过程中主反应为:6Ca(OH)2+6Cl2= Ca(ClO3)2+5CaCl2+6H2O
B. 适当减缓通Cl2速率,充分搅拌浆料,加水使Ca(OH)2完全溶解,均有利于氯气的吸收
C. 滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n[CaCl2]=1:5
D. 向滤液中加入稍过量KC1固体可将Ca(ClO3)2转化为KClO3,通过蒸发浓缩、冷却结晶的方法析出KClO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L容积不变的容器中,发生N2+3H22NH3的反应.现通入4molH2和4molN2,10s内用H2表示的反应速率为0.12mol/(Ls),则10s后容器中N2的物质的量是
A.3.6molB.3.2molC.2.8molD.1.6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com