
现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复):
阳离子:H+、Na+、Al3+、Ag+、Ba2+ 阴离子:OH-、Cl-、 CO32-、NO3-、SO42-
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
请回答下列问题:
(1)写出A与D的化学式: A______________,D_______________。
(2)写出A与E溶液反应的离子方程式:____________________________________。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1)△H=-akJ·mol-1.请写出表示相同条件下B与C的稀溶液反应的中和热的热化学方程式:________________。
(4)若25℃时,C、E及醋酸三种溶液的pH=4,则E和C溶液中由水电离出的c(H+)的比是_______________;将C与醋酸混合,醋酸的电离程度将____________(填“增大”“不变”或“减小”)(水的浓度视为常数).
(5)用惰性电极电解0.1mol·L-1 D与0.1mol·L-1C各100mL混合后的溶液,电解一段时间后,阴极质量_________(填“增大”“不变”或“减小”,下同);溶液的pH____________.
(6)向(5)中所得溶液中加入足量铁粉,则所能溶解的铁粉质量为___________g。
(1)Na2CO3 AgNO3(每空1分)
(2)2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑(2分)
(3)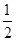 Ba(OH)2(aq)+HCl(aq)=
Ba(OH)2(aq)+HCl(aq)=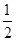 BaCl2(aq)+H2O(l)
△H=-aKJ·mol-1(2分)
BaCl2(aq)+H2O(l)
△H=-aKJ·mol-1(2分)
(4)106:1(2分) 不变(2分)
(5)不变(1分) 减小(1分) (6)0.21(2分)
【解析】
试题分析:
本题考查的是离子推断的综合题。主要与离子共存,电解质的电离,及基本概念中离子方程式的书写,反应原理中的水的电离,电解池,及相关计算等综合在一起。题目综合性较强。根据题意告知A、B、C、D、E五种可溶性强电解质,并且A、B两溶液呈碱性,根据离子共存的知识判断。CO32-不能与H+、Al3+、Ag+、Ba2+共存,不满足题目要求中可溶性强电解质。所以CO32-只能与Na+结合成Na2CO3。显然OH-不能与:H+、Al3+、Ag+结合。那只有与Ba2+结合形成Ba(OH)2。所以A、B应是Na2CO3、Ba(OH)2中的任一种。
Ag+不能与Cl-、SO42-共存。所以只能与NO3-形成AgNO3。而根据信息向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。沉淀增加后又减少,所以说明存在Al3+,所以得出B是Ba(OH)2,A是Na2CO3。沉淀又没完全消失,所以可推断出阴离子是SO42-。所以可推出E是Al2(SO4)3。剩下离子只有两种:阳离子是H+,而阴离子有Cl-。二者结合得HCl。根据D溶液与另外四种溶液反应都能产生沉淀可推断出D是AgNO3。所以综上所述可推断出各物质依次为:A:Na2CO3 B:Ba(OH)2 C:HCl D:AgNO3 E:Al2(SO4)3
(1)A为Na2CO3 D为AgNO3
(2)Na2CO3与Al2(SO4)3反应,发生双水解。离子方程式:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1)△H=-akJ·mol-1.请写出表示相同条
件下Ba(OH)2与HCl的稀溶液反应的中和热的热化学方程式:根据中和热的定义是酸与碱反应生成1molH2O所放出的热量,再把各物质状态分别标出得到: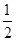 Ba(OH)2(aq)+HCl(aq)=
Ba(OH)2(aq)+HCl(aq)=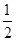 BaCl2(aq)+H2O(l)
△H=-aKJ·mol-1。
BaCl2(aq)+H2O(l)
△H=-aKJ·mol-1。
(4)HCl的pH=4,c(H+)=10-4mol/L,c(OH-)=10-10 mol/L,由水电离出的c (OH-)=10-10 mol/L,所以由水电离出的c(H+)=10-10 mol/L,Al2(SO4)3溶液的pH=4,由于Al3+的水解促进水的电离使得溶液显酸性,所以c(H+)=10-4mol/L,溶液中的H+全部来自于水,所以由水电离出的c(H+)=10-4mol/L。所以二者比值为106:1。将HCl与醋酸混合,醋酸的电离程度将不变。二者c(H+)=10-4mol/L,所以混合后c(H+)=10-4mol/L。对于水的电离平衡没有影响。
(5)0.1mol·L-1 AgNO3与0.1mol·L-1 HCl各100mL混合后,所得溶液为)0.05mol·L-1HNO3溶液和AgCl。所以此时用惰性电极电解,电解的实质是电解水。阳极析出氧气,阴极析出氢气。电解一段时间后,阴极质量不变;溶液的酸性增强,pH减小。
(6)向(5)中所得溶液中加入足量铁粉,(5)中溶液中n(HNO3)=0.01mol。足量铁粉与HNO3反应,则有3Fe~8 HNO3,n(Fe)=
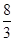 n(HNO3),m(Fe)=
n(HNO3),m(Fe)=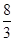 ×63g/mol×0.01mol=0.21g
×63g/mol×0.01mol=0.21g
考点:离子推断:离子共存,电解质的电离,离子方程式的书写,水的电离,电解池,及相关计算


科目:高中化学 来源: 题型:阅读理解
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
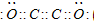
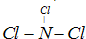
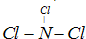
查看答案和解析>>
科目:高中化学 来源: 题型:








查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:
| D的单质 |
| D的单质 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com