
【题目】我国科学家成功实现了电解气态HCl制备Cl2,其工作原理如图所示。下列说法错误的是( )

A.a为外接直流电源的负极
B.阳极的电极反应为2HCl - 2e- ═ Cl2 + 2H+
C.通电后H+从左室迁移至右室
D.左室中发生反应为4Fe2+ + O2 + 4H+ ═ 4Fe3+ + 2H2O,实现了Fe3+的再生
科目:高中化学 来源: 题型:
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔融) ![]() 4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融)
4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融) ![]() Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
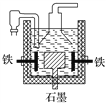
A. 电解熔融氢氧化钠制钠,阳极发生的电极反应为2OH--2e-===H2↑+O2↑
B. 盖·吕萨克法制钠原理是利用铁的还原性比钠强
C. 若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D. 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨为阳极,铁为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列有机物的系统命名或结构简式
① _____________________
_____________________
② (CH3)2CH(CH2)3CH3 _____________________
③3,4-二甲基-4-乙基庚烷_____________________
④2,3,4-三甲基戊烷_____________________
(2)写出C5H12 的同分异构的结构简式并用系统命名法命名_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知甲烷的燃烧热为890.3 kJ·mol-1,写出表示甲烷燃烧热的热化学方程式:__________________________
(2)如图是一个电化学过程的示意图,据图回答下列问题:
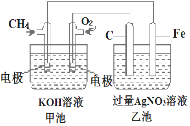
①甲池是___________________装置。
②请回答电极的名称:Fe电极的电极名称是__________
③写出电极反应式:通入CH4的电极反应式是__________________________;Fe电极的电极反应式为______________________
④乙池中反应的化学方程式为___________________________;当乙池中石墨(C)电极上生成的气体体积在标准状况下为112mL时,200mL AgNO3溶液(设乙池溶液的体积变化可以忽略)的pH值=_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________________________________________________
(2)丙组实验混合溶液中离子浓度由大到小的顺序是_____________________________
(3)丁组实验所得混合溶液中由水电离出的c(OH-)=________________mol·L-1, 混合溶液中,c(Na+)-c(A-)=_________________________mol·L-1 (不能做近似计算)。
Ⅱ.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g)H=﹣92.4kJmol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2NH3(g)H=﹣92.4kJmol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1)从0~10min内,该反应的平均速率v(H2)=________________ ;该温度下,反应达到化学平衡时,化学平衡常数K=________________ (保留二位小数)
(2)该温度下,若向容积相同的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,下列各项标志着该反应达到化学平衡状态的是________(填字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2 B.3v正(N2)=v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)该温度下,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,反应达到平衡过程中,c(H2)c(N2)c(NH3)随时间t变化如图曲线;在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上制备高纯硅通常第一步是利用石英砂和焦炭在电弧炉中制粗硅,则该反应的化学方程式是______。
(2)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
步骤Ⅰ:打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加浓盐酸。
步骤Ⅱ:A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,关闭活塞a。

①通过步骤Ⅰ知浓盐酸具有的性质是_________(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
②C装置中的试剂X是_______(填化学式),D中试剂瓶的现象是___。
③该同学用图中所示装置进行实验验证碳和硅两种元素非金属性的相对强弱的理论依据是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法不正确的是( )

A.温度为78 ℃时固体物质M的化学式为FeSO4·4H2O
B.取适量380 ℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D.温度为159 ℃时固体N的化学式为FeSO4·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出解释下列事实的离子方程式:
(1)FeCl3水溶液呈酸性:_________
(2)用Na2CO3溶液浸泡含有CaSO4的水垢:_________
(3)用稀硫酸酸化的KI淀粉溶液在空气中久置后变蓝:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com