
【题目】写出解释下列事实的离子方程式:
(1)FeCl3水溶液呈酸性:_________
(2)用Na2CO3溶液浸泡含有CaSO4的水垢:_________
(3)用稀硫酸酸化的KI淀粉溶液在空气中久置后变蓝:__________
科目:高中化学 来源: 题型:
【题目】1,2﹣环氧丁烷如图,通常为无色液体,用于制造泡沫塑料、合成橡胶、非离子型表面活性剂等。下列关于1,2﹣环氧丁烷的说法不正确的是( )
![]()
A. 化学式为C4H8O
B. 氧原子与所有碳原子可能处于同一平面
C. 能发生氧化反应和取代反应
D. 二溴代物的结构有9种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现了电解气态HCl制备Cl2,其工作原理如图所示。下列说法错误的是( )

A.a为外接直流电源的负极
B.阳极的电极反应为2HCl - 2e- ═ Cl2 + 2H+
C.通电后H+从左室迁移至右室
D.左室中发生反应为4Fe2+ + O2 + 4H+ ═ 4Fe3+ + 2H2O,实现了Fe3+的再生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 A、B、C、D、E 五种短周期元素,已知 A、B、C、D 四种元素的核内质子数 之和为 56,在元素周期表中的位置如图所示,1 mol E 的单质可与足量酸反应,能产生 33.6 L H2(在标准状况下);E 的阳离子与 A 的阴离子核外电子层结构相同。回答下列问题:

(1)写出下列元素名称 A_______,B_______, E_______
(2)C 的简单离子结构示意图为_______
(3)A 与 E 形成的化合物的化学式为_______,它的性质决定了它在物质的分类中应属于_______
(4)D 和 E 形成化合物在熔融状态下不导电,原因是______。
(5)向 D 与 E 形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是______,写出有关化学反应方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+ 6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡。下列说法正确的是
C2H5OH(g)+3H2O(g)达平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol·L-1) | 物质的平衡浓(mol·L-1) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 0.60 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(C2H5OH ,甲)﹦c(C2H5OH ,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:.
(1)室温下,用0.1mol/LNaOH溶液滴定20.00mL浓度为0.1mol/L的HA酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图:
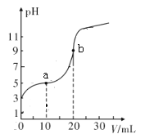
①a点对应的溶液中c(HA)____c(A-)(选填“>”“<”或“=”);b点对应的溶液中各离子浓度由大到小的顺序为_________。
②K(HA)=_________。
(2)已知:T℃时,Kw=1×10-12。在T℃时,将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(注:混合后溶液体积等于混合前两溶液体积之和)。若所得混合溶液的pH=3,则a:b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含FeCl2杂质的氯化铜晶体制纯净CuCl2·2H2O的过程是:先将晶体配制成水溶液,然后按如下图步骤进行提纯:
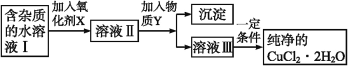
已知:在上述流程条件下,Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______。得到溶液II,最适合作氧化剂X的是______(选填以下编号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)为了除去Fe3+,需加入物质Y调节溶液的pH范围是_________________
(3)溶液Ⅲ得到CuCl2·2H2O晶体的操作是:蒸发浓缩,冷却结晶,____,___,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。

已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、____________、____________(除泥三角外)。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
(4)从F中得到固态碘还需进行的操作是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 L Al(NO3)3和Cu(NO3)2的混合溶液中c(NO3-)=0.7mol/L,用石墨作电极电解该混合溶液,当通电一段时回后,两极均有气体生成(电解前后溶液的体积变化忽略不计)。下列说法正确的是
A. 电解后溶液的pH增大 B. 电解过程中在阴极附近有沉淀生成
C. 原混合溶液中c(Al3+)=0.7mol/L D. 电解后溶液中仍有Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com