
【题目】(1)写出下列有机物的系统命名或结构简式
① _____________________
_____________________
② (CH3)2CH(CH2)3CH3 _____________________
③3,4-二甲基-4-乙基庚烷_____________________
④2,3,4-三甲基戊烷_____________________
(2)写出C5H12 的同分异构的结构简式并用系统命名法命名_____________________。
【答案】2,3-二甲基戊烷 2—甲基己烷 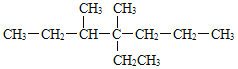
![]() CH3—CH2—CH2—CH2—CH3:戊烷;
CH3—CH2—CH2—CH2—CH3:戊烷;![]() :2-甲基丁烷;
:2-甲基丁烷;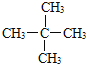 名称为2,2-二甲基丙烷
名称为2,2-二甲基丙烷
【解析】
利用碳碳单键可以旋转,选择分子中含碳原子数最多的碳链为主链,并从离支链较近的一端给主链上碳原子编号,以确定支链在主链上的位置,然后根据主链碳原子数目命名。对于给定物质分子式要确定其同分异构体结构时,先写出含碳原子数最多的碳链的同分异构体,然后主链减少碳原子,将其作支链,连接在主链的碳原子上,减少碳原子数目依次增多,但注意主链的第一个碳原子上不能有取代基,2号碳原子上不能有乙基,3号碳原子上不能有丙基,以此类推,据此解答。
①根据烷烃的系统命名方法,物质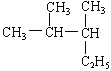 主链上有5个碳原子,从左端给主链上碳原子编号,名称为2,3-二甲基戊烷;
主链上有5个碳原子,从左端给主链上碳原子编号,名称为2,3-二甲基戊烷;
②(CH3)2CH(CH2)3CH3物质可改写为![]() ,可见主链上有6个碳原子,从左端开始给主链上碳原子编号,名称为2-甲基己烷;
,可见主链上有6个碳原子,从左端开始给主链上碳原子编号,名称为2-甲基己烷;
③3,4-二甲基-4-乙基庚烷在主链上有7个碳原子,在3号碳原子上有1个甲基;在4号碳原子上有1个甲基、1个乙基,所以其结构简式为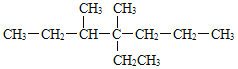 ;
;
④2,3,4-三甲基戊烷在主链上有5个碳原子,在主链的2、3、4号碳原子上分别有1个甲基所以其结构简式为![]() ;
;
(2)C5H12 的结构有CH3—CH2—CH2—CH2—CH3、![]() 、
、 三种同分异构,CH3—CH2—CH2—CH2—CH3名称为戊烷;
三种同分异构,CH3—CH2—CH2—CH2—CH3名称为戊烷;![]() 名称为2-甲基丁烷;
名称为2-甲基丁烷; 名称为2,2-二甲基丙烷。
名称为2,2-二甲基丙烷。


科目:高中化学 来源: 题型:
【题目】铅蓄电池是常见的二次电池,其原理图如图所示。铅蓄电池的工作原理为:Pb+PbO2+2H2SO4![]() 2PbSO4+ 2H2O。下列判断错误的是( )
2PbSO4+ 2H2O。下列判断错误的是( )

A.铅蓄电池的结构中O2的作用可提高电池的工作效率
B.铅蓄电池放电时Pb电极的电极反应为:Pb-2e-=Pb2+
C.电池工作时,H+移向PbO2板
D.实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是0.075mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1942 年,我国化工专家侯德榜以 NaCl、NH3、CO2 等为原料先制得 NaHCO3,进而生产出纯碱, 他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3 ;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl ;
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式_______
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是_______。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
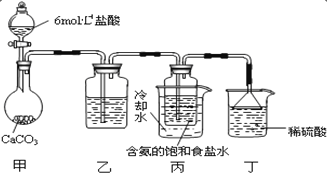
请回答:
①写出甲中发生反应的离子方程式_______。
②乙装置中的试剂是_______。
③实验结束后,分离出 NaHCO3 晶体的操作是_______ (填分离操作的名称)。
第二位同学:用如图装置进行实验(其它装置未画出)。
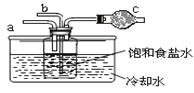
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从 a 管通入_______气体,再从b 管中通入_______气体。
②装置 c 中的试剂为_______(选填字母)。
e.碱石灰 f..浓硫酸 g.无水氯化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2﹣环氧丁烷如图,通常为无色液体,用于制造泡沫塑料、合成橡胶、非离子型表面活性剂等。下列关于1,2﹣环氧丁烷的说法不正确的是( )
![]()
A. 化学式为C4H8O
B. 氧原子与所有碳原子可能处于同一平面
C. 能发生氧化反应和取代反应
D. 二溴代物的结构有9种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa、C6H5COONa+HCl→C6H5COOH+NaCl,有关物质物理性质如表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | ﹣15 | 12 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21 g | 0.34 g | 5.9 g |
实验流程如下:
(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。若将仪器B改为仪器C,效果不如B,说明原因________。

(2)操作中有关分液漏斗的使用不正确的是___。
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集___℃的馏分。图2中有一处明显错误,正确的应改为_______。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用___冲洗杯壁上残留的晶体,抽滤完成后洗涤晶体。
(5)用电子天平准确称取0.244 0 g苯甲酸样品于锥形瓶中,加100 mL蒸馏水溶解(必要时可以加热),再用0.100 0 molL﹣1的标准NaOH溶液滴定,共消耗NaOH溶液19.20 mL,则苯甲酸样品的纯度为___%(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiO2是一种化工原料,可以制备一系列物质,下列说法正确的是
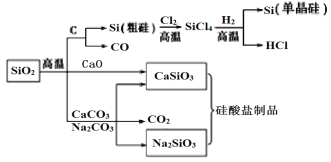
A. 图中所有反应都不属于氧化还原反应
B. 硅酸盐的化学性质稳定,常用于制造光导纤维
C. 可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸盐
D. 普通玻璃是由纯碱、石灰石和石英制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现了电解气态HCl制备Cl2,其工作原理如图所示。下列说法错误的是( )

A.a为外接直流电源的负极
B.阳极的电极反应为2HCl - 2e- ═ Cl2 + 2H+
C.通电后H+从左室迁移至右室
D.左室中发生反应为4Fe2+ + O2 + 4H+ ═ 4Fe3+ + 2H2O,实现了Fe3+的再生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含FeCl2杂质的氯化铜晶体制纯净CuCl2·2H2O的过程是:先将晶体配制成水溶液,然后按如下图步骤进行提纯:
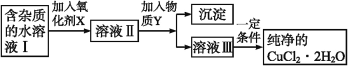
已知:在上述流程条件下,Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______。得到溶液II,最适合作氧化剂X的是______(选填以下编号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)为了除去Fe3+,需加入物质Y调节溶液的pH范围是_________________
(3)溶液Ⅲ得到CuCl2·2H2O晶体的操作是:蒸发浓缩,冷却结晶,____,___,干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com