
【题目】某可逆反应平衡常数表达式为K![]() 。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是( )
。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是( )
A.反应的热化学方程式为![]() +SO3(g)△H>0
+SO3(g)△H>0
B.一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深
C.混合气体的平均摩尔质量保持不变,说明反应已达平衡
D.使用合适的催化剂可使该反应的反应速率和平衡常数增大
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.离子化合物中只能含有离子键
B.共价化合物中可能含有离子键
C.化学键存在于分子之间
D.化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气通入鼠洞中,可以用来消灭田鼠。此过程利用了下列哪些氯气的性质( )
①黄绿色 ②密度比空气大 ③有毒 ④易液化 ⑤溶于水
A.①②③ B.②③ C.③④ D.③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亮菌甲素为利胆解痉药适用于急性胆囊炎治疗等,其结构简式如图。下列有关叙述正确的是

A.亮菌甲素中含有四种官能团
B.每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子
C.1mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗3molNaOH
D.亮菌甲素能与Na、NaOH溶液、Na2CO3溶液、NaHCO3溶液都能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某种废锂电池正极材料的主要成分是LiCoO2,含少量Al、Fe等,LiCoO2不溶于水。实验室回收废锂电池制备锂单质的流程如图所示:
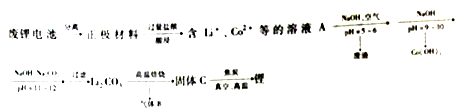
(1)正极材料酸浸时发生主要反应的化学方程式为_______。某同学从环境保护的角度考虑上述做法不合理,理由是_______,于是提出可用酸化的双氧水代替盐酸,则反应的离子方程式为______。
(2)Li2CO3在高温焙烧时发生反应的化学方程式为______。
(3)固体C与焦炭的反应需在真空条件下进行的原因是_______。
(4)工业上采用熔融盐电解法制备金属锂,电解质为熔融的LiCl-KCl,采用石墨阳极和低碳钢阴极,则阴极的电极反应式为______。如果用LiCl的水溶液代替熔融的LiCl-KCl,则其后果是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修3:物质结构与性质】(15分)
A、B、C、D四种元素的原子序数依次增大,A的一种原子不含有中子,B原子p轨道有三个未成对电子,C是非金属元素且s轨道上的电子总数等于p轨道上的电子总数,D的原子序数为29。回答下列问题:
(1)D的基态电子排布式为___________________________。
(2)A、B、C元素的第一电离能由大到小的顺序为________________(填元素符号)。
(3)A和B能形成两种常见的化合物BA3和B2A4,试比较两者的沸点的高低:________________(用化学式表示),说明原因:_________________________________。
(4)A和C形成的一种化合物为常见的液态物质,但该物质由液体形成固体后密度却减小。试解释原因:___________________________________。
(5)A、B、C、D四种元素可以形成一种原子个数比为12:6:6:1的配合物,请写出该化合物的化学式:____,其中B原子的杂化类型为________________。
(6)D晶体的堆积类型为_________,其空间利用率为______________(请计算出准确值,可用根式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10mol/LKHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 。
(3) 完成并配平下列离子方程式:
C2O42- + MnO4—+ H+ = CO2↑+ Mn2+ +
(4)步骤③中判断滴定终点的方法是 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)试样中H2C2O4·2H2O的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com