
【题目】下列对实验操作及结论的描述不正确的是( )
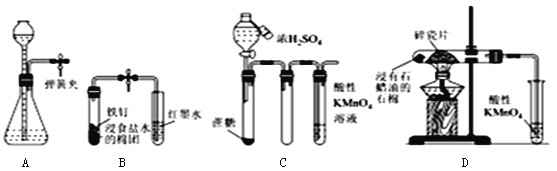
A. 夹紧弹簧夹,由长颈漏斗加水至产生液面差,一段时间后液面差不变,说明气密性良好
B. 打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀
C. 滴加浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化硫
D. 加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯
科目:高中化学 来源: 题型:
【题目】I、有X、Y、Z、W四种化合物,其中X常用作焙制糕点所用的发酵粉,X、Y、Z的焰色反应均为黄色,W为无色无味的气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
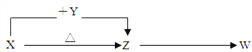
(1)W的化学式是__________;
(2)X与Y在溶液中反应的离子方程式是:___________________________;
II、某混合物![]() ,含有
,含有![]() 、
、![]() 和
和![]() ,在一定条件下可实现如图所示的物质之间的变化:
,在一定条件下可实现如图所示的物质之间的变化:
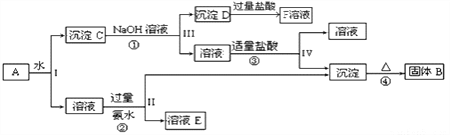
据此回答下列问题:
(1)根据上述框图反应关系,写出![]() 、
、![]() 所含物质的化学式:
所含物质的化学式:
固体![]() __________、溶液
__________、溶液![]() ______________________________
______________________________
(2)如果把步骤③中适量的盐酸改为过量的二氧化碳,则反应的离子方程式___________________________________________________________。
(3)在空气中将NaOH溶液滴入F溶液中,观察到的现象是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑中主要成分为Cu和Fe,此外还含有少量![]() ,该厂用上述废金属屑制取新型高效水处理剂
,该厂用上述废金属屑制取新型高效水处理剂![]() (高铁酸钠)等产品,过程如下:
(高铁酸钠)等产品,过程如下:
I. 向废金属屑中加入稀![]() ,充分反应后,剩余两种固体单质和溶液;
,充分反应后,剩余两种固体单质和溶液;
II. 向I所得固体中继续加入足量稀![]() ,过滤后,向所得固体中加入硫酸酸化的
,过滤后,向所得固体中加入硫酸酸化的![]() ,固体溶解得
,固体溶解得![]() 溶液;
溶液;
III. ……
(1)步骤I所得溶液中加入KSCN溶液无明显现象,用离子方程式解释其可能的原因______________________________________。步骤I所得溶液中滴加NaOH溶液,看到的现象是________,涉及的化学反应方程式是_________、_______________。向I所得固、液混合物中通入过量氯气,并不断搅拌,充分反应后,溶液中的金属阳离子是(填写离子符号)____________。
(2)步骤II中![]() 在酸性条件下氧化了铜,获得
在酸性条件下氧化了铜,获得![]() 溶液。参加反应的
溶液。参加反应的![]() 与Cu的物质的量之比为____________。
与Cu的物质的量之比为____________。
(3)步骤I所得溶液经进一步处理可制得![]() ,流程如下:
,流程如下:
![]()
写出由![]() 制取
制取![]() 的离子反应方程式______________________。
的离子反应方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)生成的黑色(单质)物质是__________ (填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是___________ (填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为:______________________________________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有__________(填序号)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(4)将实验(2)产生的刺激性气味气体通入品红溶液,可以看到品红溶液_________ 说明这种气体具有_____________________性;将(2)中产生的刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验(已知硝酸根离子在酸性环境中具有强氧化性,还原产物一般为气体)

下列有关判断正确的是
A. 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 试液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中发生反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 沉淀B在空气中会迅速变为灰绿色,最后变为红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空.
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) .
A.9
B.13
C.11~13之间
D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) .
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH﹣)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①和两种粒子的物质的量之和等于0.1mol.
②和两种粒子的物质的量之和比OH﹣多0.05mol.
(4)已知某溶液中只存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
C.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
D.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 , 上述离子浓度大小顺序关系中正确的是(选填序号) .
②若上述关系中C是正确的,则溶液中溶质的化学式是 .
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)c(NH3H2O)(填“>”、“<”、或“=).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8,E与B的质量比为1:1.根据以上条件,回答下列问题:
(1)写出D元素符号 .
(2)写出D原子的价电子排布式 .
(3)写出A元素在B中完全燃烧的化学方程式 .
(4)指出E元素在元素周期表中的位置 .
(5)比较A、B、C三种元素的第一电离能的大小顺序(用元素符号表示).
(6)比较元素D和E的电负性的相对大小(用元素符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.不粘锅的原料 ![]() 为烃类化合物
为烃类化合物
B.分子组成相差1个或若干个“CH2”原子团的有机物,互称为同系物
C.石油分馏是物理变化,煤的气化、液化是化学变化
D.油脂在酸性或碱性条件下都能发生水解反应制取肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图所示化合物的说法不正确的是 ( ) 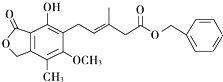
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1mol该化合物最多可以与3molNaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com