
【题目】下列对X+2Y=X2++2Y-的叙述中正确的是
A.Y被还原,X2+是还原产物 B.Y被还原,X发生氧化反应
C.X是还原剂,Y被氧化 D.X被氧化,X显氧化性
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质用途的说法中,不正确的是( )
A. Fe2O3可以做油漆的颜料
B. 王水可以雕刻玻璃
C. Al2O3可用作耐火材料
D. 赤铁矿可用作炼铁的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,含A元素的有关微粒物质的量变化如下图所示。根据图示判断,下列说法正确的是
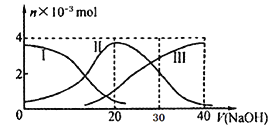
A. H2A在水中的电离方程式是:H2A== H++HA-;HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)=c(A2-)+2c(OH-)
D. 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碱性蓄电池在充电和放电时发生的反应为:
Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列说法中正确的是
Fe(OH)2+Ni(OH)2,下列说法中正确的是
A. 放电时,负极上发生反应的物质是Fe
B. 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2
C. 充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O
D. 充电时,阳极附近pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E原子序数依次增大 ,A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为_______。W的电子式_________。
(2)在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)![]() X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
平衡时n(X) | 0.5 mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 |
|
|
|
① 计算该温度下此反应的平衡常数K =_________________。
②三个容器中的反应分别达平衡时下列各组数据关系正确的是___________(填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
(3)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
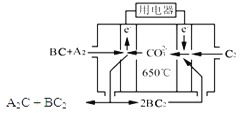
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:

①2SO2(g)+O2(g)![]() 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是_________。
a.体系的密度不发生变化 b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化 d.单位时间内反应物转移4 mol 电子,同时消耗2 mol SO3 e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) ![]() 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①升高温度,该反应的平衡常数__________(填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)=________,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为________(填“a”或“b”或“c”或“d”)。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 ______点,温度T1 ___T2(填“>”或“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )
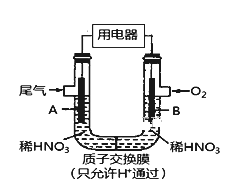
A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C(s)+CO2(g) 2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强 ②增加碳的量 ③恒容充入CO2 ④恒容下充入N2 ⑤ 恒压下充入N2。能够使反应速率增大的措施是( )
A. ①④B. ②③⑤C. ①③D. ①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com