
| m |
| M |
| 44.8g |
| 44g/mol |
| m |
| M |
| 11.2g |
| 56g/mol |
| 1400.32 |
| 2800 |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
| A、元素的原子序数依次递增,元素相对原子质量也依次递增 |
| B、主族元素原子的最外层电子数等于它的最高正价数 |
| C、主族元素原子的电子层数等于其所处的周期数 |
| D、随核电荷数的递增,离子半径也依次递减 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
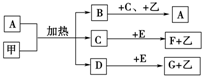 已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应,甲是常见的固体单质,乙是常见的气体单质,B是无色气体,是主要的大气污染物之一,请根据图示回答问题.
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应,甲是常见的固体单质,乙是常见的气体单质,B是无色气体,是主要的大气污染物之一,请根据图示回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
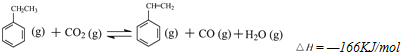
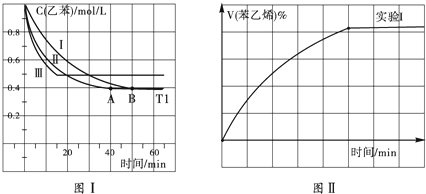
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 操作 |
| (1)SiO2(CaCO3) | ||
| (2)SiO2(Si) | ||
| (3)NaCl(SiO2) | ||
| (4)SiO2(H2SiO3) | ||
| (5)Fe2O3(SiO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com