
| A、一定温度下,在固定体积的密闭容器中发生可逆反应A(s)+B(g)?C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态 | ||
| B、对于反应C(s)+CO2(g)?2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大 | ||
| C、室温下CH3COOH的Ka=1.7×10-5,NH3?H2O的Kb=1.7×10-5,CH3COOH溶液中的c (H+)与氨水中的c(OH-)相等 | ||
D、常温下向Mg(OH)2悬浊液中加入MgCl2浓溶液后,溶液中
|
| Ka?c(CH3COOH) |
| Kb?c(NH3?H2O |
| c(Mg2+)c(OH-) |
| c(H+) |
| Ksp |
| KW |
| Ka?c(CH3COOH) |
| Kb?c(NH3?H2O |
| c(Mg2+)c(OH-) |
| c(H+) |
| Ksp |
| KW |
| c(Mg2+)c(OH-) |
| c(H+) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
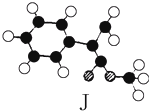 肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基.又知J为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).
肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基.又知J为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).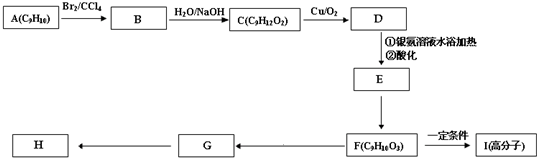
查看答案和解析>>
科目:高中化学 来源: 题型:
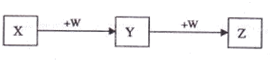
| A、若W是单质铁,则Z溶液可能是FeCl2溶液 |
| B、若W是氢氧化钠,则X水溶液呈酸性 |
| C、若W是氧气,则X、Z的相对分子质量可能相差48 |
| D、若W是强氧化性的单质,则X可能是金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
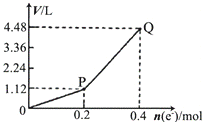 用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )
用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )| A、电解过程中,溶液的pH不断增大 |
| B、当转移0.4mol e-时,电解生成的铜为6.4g |
| C、阳极电极反应式为2H2O+4e-=4H++O2↑ |
| D、Q点对应的气体中,H2与O2的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室要测定某氯化铜溶液中溶质的质量分数,取该溶液100g,逐滴滴加一定溶质质量分数的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.(反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaCl)求:
实验室要测定某氯化铜溶液中溶质的质量分数,取该溶液100g,逐滴滴加一定溶质质量分数的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.(反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaCl)求:查看答案和解析>>
科目:高中化学 来源: 题型:
A、2NaCl(水溶液)
| ||
B、CuO+H2
| ||
C、Fe3O4+4CO
| ||
D、2HgO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
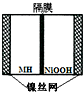 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池 (MH-Ni碱性电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池 (MH-Ni碱性电池).下列有关说法不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-=Ni(OH)2+OH- |
| B、放电时负极反应为:MH+OH--2e-=H2O+M+ |
| C、充电时氢氧根离子移向阳极,要参与电极反应 |
| D、充电时电池的正极连接直流电源的正极,得到电子发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g氮气所含有的原子数目为NA |
| B、化学反应中1mol金属镁变成镁离子时失去电子数目为2NA |
| C、标准状况下,22.4L水中含有个水分子NA |
| D、标准状况下,22.4L氯化氢所含的原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com