
已知Fe3O4与1 mol Al反应转化为Fe单质时放出a kJ的热量,写出该反应的热化学方程式___________________________________________________。
(2)(2012·北京)利用反应:4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:
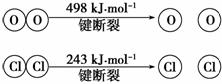
若上述反应中,4 mol HCl被氧化,放出115.6 kJ的热量,则该反应的热化学方程式是_________________________________________________________________ _______。
_______。
断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________ kJ。
(3) (2012·新课标全国)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为________。
(2012·新课标全国)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为________。
解析 (1)Al与Fe3O4反应的化学方程式为:8Al+3Fe3O4 4Al2O3+9Fe,则8 mol Al完全反应放出8a kJ热量。
4Al2O3+9Fe,则8 mol Al完全反应放出8a kJ热量。
(2)书写热化学方程式时,要注意四种物质均为气态,且ΔH的符号为“-”。设1 mol H—O键断开时需要的能量为x,1 mol H—Cl键断开时需要的能量为y,由热化学方程式得出等式:(4y+498 kJ·mol-1)-(4x+2×243 kJ·mol-1)=-115.6 kJ,解得x-y=31.9 kJ≈32 kJ。(3)首先写出热化学方程式:
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1 ①
CO(g)+ O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283.0 kJ·mol-1 ②
H2(g)+ O2(g)===H2O(l)
O2(g)===H2O(l)
ΔH=-285.8 kJ·mol-1 ③
①-(②+③)×2得
CH4(g)+CO2===2CO(g)+2H2(g)
ΔH=+247.3 kJ·mol-1
故标准状况下生成1 m3 CO所需热量为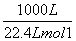 ×
× ×247.3 kJ·mol-1≈5.52×103 kJ。
×247.3 kJ·mol-1≈5.52×103 kJ。
答案 (1)8Al(s)+3Fe3O4(s)===9Fe(s)+4Al2O3(s) ΔH=-8a kJ·mol-1 (2)4HCl(g)+O2(g)===2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1 32 (3)5.52×103 kJ


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体。
(1)M的基态原子价层电子排布式为___________________________________________,元素B、D、G的第一电离能由大到小的顺序是________________________(用元素符号表示)。
(2)用价层电子对互斥理论预测,GD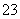 的立体构型是____________(用文字表述)。
的立体构型是____________(用文字表述)。
(3)M与D形成的一种橙红色晶体晶胞结构如下图所示,其化学式为________(用元素符号表示)。
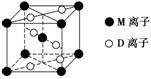
(4)已知化合物EB结构与单晶硅相似,该物质可由E的氯化物与NaB3在高温下反应制得,且生成单质B2,该反应化学方程式为_______________________________________________,若有8.4 g B2生成,则转移电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.NaHCO3+H2 HCOONa+H2O反应中,储氢、释氢过程均无能量变化
HCOONa+H2O反应中,储氢、释氢过程均无能量变化
B.如图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
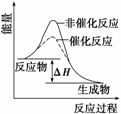
C.化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律
D.2SO2(g)+O2(g)===2SO3(g)和4SO2(g)+2O2(g)===4SO3(g)的ΔH相等
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
C.在常温常压下,11.2 L Cl2含有的分子数为0.5 NA
D.标准状况下,11.2 L H2O含有的分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
使用胆矾(CuSO4·5H2O)配0.1 mol·L-1的硫酸铜溶液,正确的操作( )
A.将胆矾加热除去结晶水后,称取16 g溶解在1 L水里
B.称取胆矾25 g,溶解在1 L水里
C.将25 g胆矾溶于水,然后将此溶液稀释至1 L
D.将16 g胆矾溶于水,然后将此溶液稀释至1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平。A、B、C、D、E有如图所示的关系。
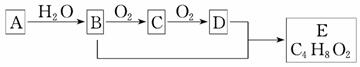
则下列推断不正确的是( )
A.鉴别A和甲烷可选择酸性高锰酸钾溶液
B.B、D均能与金属钠反应
C.物质C的结构简式为CH3CHO
D.B+D→E的化学方程式为:
CH3CH2OH+CH3COOH CH3COOC2H5
CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质灼烧时,焰色反应为黄色,则下列判断不正确的是( )
A .该物质可能是钠的化合物 B.该物质一定含钠元素
.该物质可能是钠的化合物 B.该物质一定含钠元素
C.该物质一定是金属钠 D.不能确定该物质中是否含有钾元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com