
下列说法正确的是
A.NaHCO3+H2 HCOONa+H2O反应中,储氢、释氢过程均无能量变化
HCOONa+H2O反应中,储氢、释氢过程均无能量变化
B.如图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
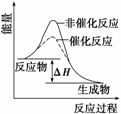
C.化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律
D.2SO2(g)+O2(g)===2SO3(g)和4SO2(g)+2O2(g)===4SO3(g)的ΔH相等
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A. W2-、X+ B. X+、 Y3+
C. Y3+、 Z2- D. X+、 Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
在t℃下,某反应达到平衡,平衡常数K=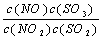 。恒容时,温度升高,NO浓度减小。下列说法正确的是 ( )
。恒容时,温度升高,NO浓度减小。下列说法正确的是 ( )
A.该反应的焓变为正值
B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度
C.升高温度,逆反应速率减小
D.该反应化学方程式为:NO+SO3 NO2+SO2
NO2+SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下表给出几种氯化物的熔点和沸点:
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化铝晶体是典型的离子晶体。其中与表中数据一致的是
A.①② B.②③
C.①②④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)===Cu2+(aq)+H2(g)
ΔH=+64.39 kJ·mol-1
2H2O2(l)===2H2O(l)+O2(g)
ΔH=-196.46 kJ·mol-1
H2(g)+ O2(g)===H2O(l)
O2(g)===H2O(l)
ΔH=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
A.-417.91 kJ·mol-1 B.-319.68 kJ·mol-1
C.+546.69 kJ·mol-1  D.-448.46 kJ·mol-1
D.-448.46 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-1 452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B. H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)===
Ba(OH)2(aq)=== BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)===CH3OH(l)+H2O(l)
ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Fe3O4与1 mol Al反应转化为Fe单质时放出a kJ的热量,写出该反应的热化学方程式___________________________________________________。
(2)(2012·北京)利用反应:4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:
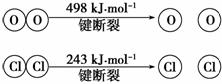
若上述反应中,4 mol HCl被氧化,放出115.6 kJ的热量,则该反应的热化学方程式是_________________________________________________________________ _______。
_______。
断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________ kJ。
(3) (2012·新课标全国)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为________。
(2012·新课标全国)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO 等杂质。某次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。某次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO ,其原因是____________________________________。[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)= 5.1 ×10-9]
,其原因是____________________________________。[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)= 5.1 ×10-9]
②该法工艺原理示意图如下。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
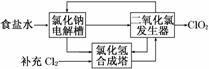
工艺中可以利用的单质有________(填化学式),发生器中生成ClO2的化学方程式为_____________________________________________________________________________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□____(D)____+24NaClO3+12H2SO4===□ClO2↑+□CO2↑+18H2O+□________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com