
【题目】利用下图装置(夹持装置略)制取和收集纯净、干燥的氨气,并探究氨气的性质。
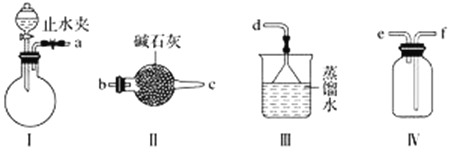
(1)关闭装置Ⅰ中的止水夹,向分液漏斗中加适量水,打开活塞,说明Ⅰ气密性良好的现象是______________________。
(2)利用装置Ⅰ制取氨气,不能选用的试剂为浓氨水和________(填字母)。
A.氢氧化钠 B.碱石灰 C.硝酸钾 D.生石灰
(3)根据实验要求,仪器连接的顺序(用字母编号表示):a接________、________接________、______接______。______
(4)收集氨气,按如图装置进行NH3性质的探究实验。
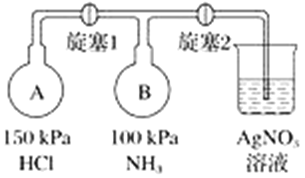
①打开旋塞1,B瓶中的现象是_________________________________________,原因是_____________________________________________,稳定后,关闭旋塞1;
②再打开旋塞2,B瓶中的现象是__________________________________________。
【答案】分液漏斗内液面不再下降 C c b e f d 产生白色的烟 氯化氢与氨气反应生成了氯化铵小颗粒,NH3+HCl=NH4Cl,氯化铵小颗粒形成白烟 烧杯中的硝酸银溶液会倒流进入到B瓶中,B瓶中生成白色沉淀(提示:A中气体压强大于B中)
【解析】
(1)利用注水法检验装置的气密性;
(2)利用装置I制取氨气,为常温下固液制取气体的装置,据此分析;
(3)依据氨气的物质性质和化学性质选择连接方式;
(4)A中压强大,HCl进入B中,与氨气反应生成氯化铵固体;关闭旋塞①,再打开旋塞②,烧杯中的AgNO3溶液会倒流进入到B瓶中,反应生成AgCl。
(1)关闭A装置中的止水夹,向分液漏斗中加入适量水,打开活塞,分液漏斗内液面高度保持不变(或液体不再滴下),说明A装置气密性良好,故答案为:分液漏斗内液面不再下降;
(2)利用装置I制取氨气,为常温下固液制取气体的装置,可为浓氨水与CaO、氢氧化钠,CaO+H2O=Ca(OH)2、消耗水并放热,根据NH3+H2O![]() NH3
NH3![]() H2O
H2O![]() NH4++OH-可知,氢氧化钙、氢氧化钠溶于水电离出氢氧根离子,氢氧根离子浓度增大平衡逆向移动,使氨气逸出,且温度升高,降低氨气的溶解度,使氨气逸出,A、B、D符合条件,硝酸钾溶于水没有明显的热效应,不能与浓氨水制备氨气,故答案为:C;
NH4++OH-可知,氢氧化钙、氢氧化钠溶于水电离出氢氧根离子,氢氧根离子浓度增大平衡逆向移动,使氨气逸出,且温度升高,降低氨气的溶解度,使氨气逸出,A、B、D符合条件,硝酸钾溶于水没有明显的热效应,不能与浓氨水制备氨气,故答案为:C;
(3)利用装置I制取氨气,制出的氨气中含有水蒸气,需进行干燥,选用装置Ⅱ,粗口进,细口出,所以a连接cb;根据氨气的密度小于空气的密度,应为向下排气法收集,所以选择收集装置应为“短进长出”,所以再连接ef,氨气属于极易溶于水,还是大气污染气体,用防倒吸的装置进行尾气吸收连接d,所以连接顺序为cbefd,故答案为:c;b;e;f;d;
(4)A容器压强为150 kPa,B容器压强100 kPa,A容器压强大于B容器,先打开旋塞①,A容器中的氯化氢进入B容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以B瓶中的现象是出现白烟,氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,再打开旋塞②,硝酸银倒吸入B瓶中,氯化铵与硝酸银反应生成白色的氯化银沉淀。故答案为:产生白色的烟;氯化氢与氨气反应生成了氯化铵小颗粒,NH3+HCl=NH4Cl,氯化铵小颗粒形成白烟;烧杯中的硝酸银溶液会倒流进入到B瓶中,B瓶中生成白色沉淀(提示:A中气体压强大于B中)。


科目:高中化学 来源: 题型:
【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
Ⅰ.以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图所示:
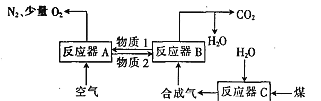
①C(s) +H2O(g) = CO(g)+ H2(g) ΔH = akJmol-1
②CO(g)+ H2(g) + O2(g) = CO2(g) +H2O(g) ΔH = bkJmol-1
(1)写出图中总反应的热化学方程式:_____________________________
(2)空气经反应器A后得到的尾气___________(填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____________________。
Ⅱ.用FeO作载氧剂,部分反应的lgKp [K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图所示。
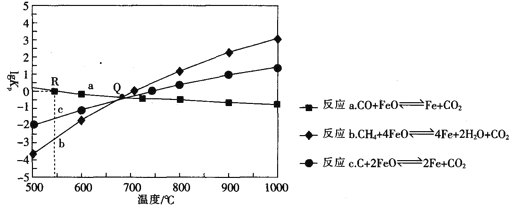
(3)图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________.
CO2(g) +Fe(s),则CO的平衡转化率为______________.
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp = _____________________.
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗amolA,同时生成3amolCB.C的生成速率与C分解的速率相等
C.容器内压强不再变化D.混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B. 已知, N2 (g) + 3 H2(g)![]() 2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
D. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.0.5molAl与足量盐酸反应转移电子数为NA
C.46gNO2和N2O4的混合物含有的分子数为NA
D.同温同体积时,两种气体的压强比等于物质的量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是

A. 以铅蓄电池为电源,则a极为Pb电极
B. 石墨Ⅱ电极附近的pH逐渐减小
C. 阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+
D. 每处理含8.8g乙醛的废水,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I .以下是实验室常用的部分仪器,请回答下列问题:
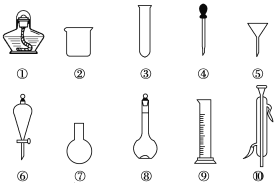
(1)序号为⑧和⑩的仪器的名称分别为______、______。
(2)在分液操作中,必须用到上述仪器中的____(填序号)。
(3)能作反应容器且可直接加热的仪器是上述中的___(填名称)。
(4)在配制溶液时,需要用到的仪器是________(填序号)。
(5)仪器上标有温度的是____(填序号)。
‖.请选择下列实验方法分离混合物,并将分离方法的序号填在横线上。
A 萃取分液; B 升华; C 结晶 ;D 分液 ;E 蒸馏 ; F 过滤。
(1)___分离饱和食盐水与沙子的混合物。
(2)___从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)____分离水和汽油的混合物。
(4)___分离CCl4和苯(二者互溶)的混合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.HCO3-水解:HCO3-+H2OCO32-+H3O+
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com