
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.0.5molAl与足量盐酸反应转移电子数为NA
C.46gNO2和N2O4的混合物含有的分子数为NA
D.同温同体积时,两种气体的压强比等于物质的量之比
【答案】D
【解析】
A.在同温同压时,相同体积的任何气体单质所含的分子数目相同,但由于气体有单原子和双原子的,所以含有的原子数不一定相等,故A错误;
B.Al与足量盐酸反应生成Al3+,化合价升高三价,所以0.5molAl与足量盐酸反应转移电子数为1.5NA,故B错误;
C.46gNO2的物质的量为![]() =1mol ,所含分子数为NA个,46gN2O4的物质的量为0.5mol,所含分子数为0.5NA个,所以46gNO2和N2O4的混合物含有的分子数应介于0.5NA~ NA个,故C错误;
=1mol ,所含分子数为NA个,46gN2O4的物质的量为0.5mol,所含分子数为0.5NA个,所以46gNO2和N2O4的混合物含有的分子数应介于0.5NA~ NA个,故C错误;
D.根据阿伏加德罗定律的推论:同温同体积时,两种气体的压强比等于物质的量之比,故D正确;
故答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
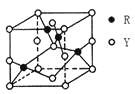
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当不慎有大量Cl2扩散到周围空间时,处在环境中的人们可以用浸有一定浓度某种物 质水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是
A.NaOHB.NaClC.NaHCO3D.NH3![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g)![]() C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. a=2
B. 达到平衡时A的转化率为60%
C. 速率随时间变化关系如图所示
D. 为提高A的转化率,可采取升高温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置(夹持装置略)制取和收集纯净、干燥的氨气,并探究氨气的性质。
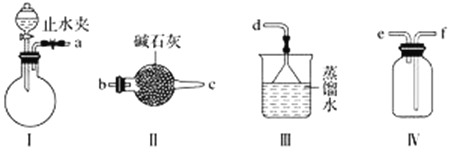
(1)关闭装置Ⅰ中的止水夹,向分液漏斗中加适量水,打开活塞,说明Ⅰ气密性良好的现象是______________________。
(2)利用装置Ⅰ制取氨气,不能选用的试剂为浓氨水和________(填字母)。
A.氢氧化钠 B.碱石灰 C.硝酸钾 D.生石灰
(3)根据实验要求,仪器连接的顺序(用字母编号表示):a接________、________接________、______接______。______
(4)收集氨气,按如图装置进行NH3性质的探究实验。
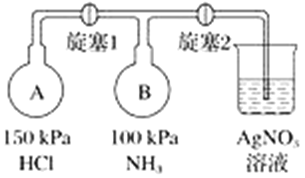
①打开旋塞1,B瓶中的现象是_________________________________________,原因是_____________________________________________,稳定后,关闭旋塞1;
②再打开旋塞2,B瓶中的现象是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】门捷列夫周期表是常见的经典形式,人们在研究前18号元素时发现,还可以将它们排成如图所示的“海螺”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )

A. A、B元素的简单离子半径比较A﹥B
B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素
D. A、B两种元素组成的化合物中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、W、Q的原子序数依次增。X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912。回答下列问题:
(1)基态Q原子的核外电子排布式是____________________。
(2)Q、W形成的化合物Q2W2中的化学键类型是______________。
(3)Y能与氟元素形成YF3,该分子的空间构型是_______,该分子属于______分子(填“极性”或“非极性”)。Y与X可形成具有立体结构的化合物Y2X6,该结构中Y采用______杂化。
(4)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式_______________。
(5) Z的一种单质晶胞结构如下图所示。
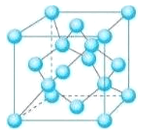
①该单质的晶体类型为___________。
②含1 mol Z原子的该晶体中共有_____mol化学键。
③己知Z的相对原子质量为M,原子半径为r pm,阿伏伽德罗常数的值为NA,则该晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
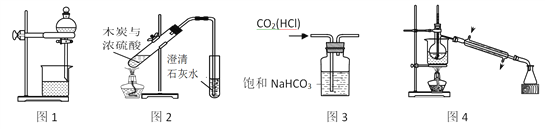
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g),常压下该反应在1900℃的高温下才能进行,说明该反应的ΔH<0
B.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
C.将MgCl2·6H2O在坩埚中加热可获得MgCl2
D.反应2H2(g)+O2(g)![]() 2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和反应中断裂旧共价键的键能之和
2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和反应中断裂旧共价键的键能之和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com