
【题目】根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的是( )
A. PCl3 B. HCHO
C. H3O+ D. PH3
【答案】B
【解析】
根据价层电子对互斥理论确定其空间构型,价层电子对数=σ 键个数+![]() (a-xb),据此分析判断。
(a-xb),据此分析判断。
A.三氯化磷分子中,价层电子对数=3+![]() (5-3×1)=4,且含有一个孤电子对,所以其空间构型是三角锥型,故A不符合;B.甲醛分子中,价层电子对数=3+
(5-3×1)=4,且含有一个孤电子对,所以其空间构型是三角锥型,故A不符合;B.甲醛分子中,价层电子对数=3+![]() (4-2×1-1×2)=4,且不含孤电子对,所以其空间构型是平面三角形,故B符合;C.水合氢离子中,价层电子对数=3+
(4-2×1-1×2)=4,且不含孤电子对,所以其空间构型是平面三角形,故B符合;C.水合氢离子中,价层电子对数=3+![]() (6-1-3×1)=4,且含有一个孤电子对,所以其空间构型是三角锥型,故C不符合;D.PH3分子中,价层电子对数=3+
(6-1-3×1)=4,且含有一个孤电子对,所以其空间构型是三角锥型,故C不符合;D.PH3分子中,价层电子对数=3+![]() (5-3×1)=4,且含有一个孤电子对,所以其空间构型是三角锥型,故D不符合;故选B。
(5-3×1)=4,且含有一个孤电子对,所以其空间构型是三角锥型,故D不符合;故选B。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4是制备高纯MnCO3的中间原料。实验室用如图所示装置可制备少量MnSO4溶液,反应原理为:MnO2+H2SO3=MnSO4+H2O;下列说法错误的是( )
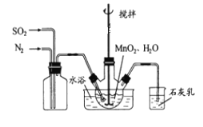
A. 缓慢通入混合气体可提高SO2的转化率
B. 若不通N2,则烧瓶中的进气管口容易被堵塞
C. 若实验中将N2换成空气,则反应液中c(Mn2+)/c(SO42-)的浓度之比变大
D. 石灰乳对尾气的吸收效果比澄清石灰水更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究草酸亚铁(FeC2O4)的热分解产物,按下面所示装置进行实验。以下说法错误的是
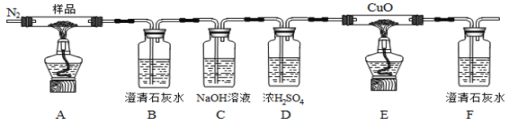
A. 实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO气体
B. 反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C. 装置C的作用是除去混合气中的CO2
D. 反应结束后,应熄灭A、E处酒精灯后,持续通入N2直至温度恢复至室温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: Zn2+、SO42-、NH4+,Cl-
B. 0.1mol/L NaHCO3溶液中: Mg2+、Al3+、K+、NO3-
C. 能使甲基橙变黄的溶液中: Na+,CH3COO-、 MnO4-、 Fe3+
D. c(H+)/c(OH-)=1×1012的溶液中:NO3-、I-、K+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
A.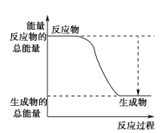 B.
B.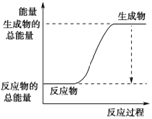
(4)为加快反应速率,可以采取的措施__________。
a.降低温度;b.增大压强;c.恒容时充入He气;d.恒压时充入He气;e.及时分离出NH3
(5)下列可判断反应已达到平衡状态的是__________。
A 气体的平均摩尔质量不变
B N2、H2的反应速率比为1:3
C 混合气体的密度不变
D 生成1mol N2的同时生成2mol NH3
E N2、H2、NH3物质的量之比等于系数比
F 混合气体的总压强不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜混合粉末17.6 g加入到800mL 1.0mol/L的 FeCl3溶液中,充分反应后,所得溶液中Fe2+和Cu2+物质的量浓度之比为8∶1。下列有关说法正确的是
A. 混合粉末中铁与铜的物质的量之比是1∶2
B. 反应后的溶液最多还可以溶解铁粉5.6g
C. 反应后所得溶液中c(Fe2+)=1.0mol/L (假设反应前后溶液体积无变化)
D. 向反应后的溶液中加入2.0 mol/L NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是1.6 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com