
| N |
| NA |
| n |
| V |
| V |
| Vm |
| m |
| M |
| n |
| V |
| n |
| NAmol-1 |
| n |
| NA |
| ||
| VL |
| n |
| VNA |
| n |
| VNA |
| 20 |
| 20+9a |
| 2000 |
| 20+9a |
| 2000 |
| 20+9a |
| 500L |
| 22.4L/mol |
| ||
1000+
|
| ||
1000+
|
| b |
| 106 |
| ||
| b |
| 106 |
| b |
| 53 |
| ||
| 0.1L |
| 10b |
| 53 |
| 10b |
| 53 |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| A、①③④ | B、②③④ |
| C、①④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙酸与乙醇的反应CH3COOH+CH3CH218OH
| ||||
| B、苯酚钠溶液和少量CO2反应:2C6H5O-+CO2+H2O=2C6H5OH+CO32- | ||||
| C、用醋酸去除水垢:CaCO3+2H+=Ca2++CO2↑+H2O | ||||
D、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH4)2OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3种元素的气态氢化物中,Z的气态氢化物最稳定 |
| B、Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C、元素非金属性由弱到强的顺序为Z<Y<X |
| D、原子半径由大到小的顺序为X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0×10-3 mol |
| B、1.6×10-3 mol |
| C、2.2×10-3 mol |
| D、2.4×10-3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
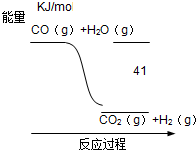
| A、CO+H2O═CO2+H2 △H=-41 KJ/mol |
| B、CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41 KJ/mol |
| C、CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41 KJ/mol |
| D、CO2(g)+H2(g)═CO(g)+H2O(g)△H=-41 KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com