
 ,故答案为:
,故答案为: ;
;
| ||
| a |
| 22.4 |
| a |
| 22.4×5 |
| ||
| a |
| 22.4×5 |
| 2a |
| 22.4×5 |
| 2a |
| 22.4×5 |
| 2×24a |
| 22.4×5 |
| 3a |
| 7 |
| ||
| 2×24a |
| 22.4×5 |
| 3a |
| 7 |


科目:高中化学 来源: 题型:
A、H2O(g)═H2(g)+
| ||
| B、2H2(g)+O2(g)═2H2O(l)△H=-484kJ?mol-1 | ||
C、H2(g)+
| ||
| D、2H2(g)+O2(g)═2H2O(g)△H=+484kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
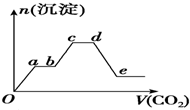 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )| A、Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O |
| B、ab段与cd段所发生的反应相同 |
| C、de段沉淀减少是由于BaCO3固体消失的 |
| D、bc段反应的离子方程式是2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com