
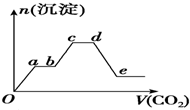
 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )| A、Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O |
| B、ab段与cd段所发生的反应相同 |
| C、de段沉淀减少是由于BaCO3固体消失的 |
| D、bc段反应的离子方程式是2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- |


科目:高中化学 来源: 题型:
| c(H+) |
| c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计的水银球在蒸馏烧瓶的支管口处 |
| C、过滤时,玻璃棒在引流过程中应放在三层滤纸处 |
| D、称量时,称量物放在称量纸上,置于托盘天平左盘,砝码直接放在托盘天平右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②③④ |
| C、①④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
| B、标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA |
| C、常温常压下,18g H2O中含有的电子数为3NA |
| D、常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com