
 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:分析 (1)晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2)Fe原子序数为26,原子结构中有4个电子层,价电子为3d64s2,据此判断铁元素位于元素周期表中的位置;Fe3+离子3d为半满稳定状态,比较稳定;根据Fe原子的核外电子排布式确定未成对电子数;
(3)Al2Cl6结构中黑色球为Al原子、白色球为Cl原子,Al原子与Cl原子之间形成3个共价键、1个配位键,Al原子杂化轨道数目为4;
(4)配位化合物Fe(CO)5,该物质熔沸点低,易溶于非极性溶剂,属于分子晶体;
(5)电子由较高能级跃迁到较低能级时,以光的形式释放能量.
解答 解:(1)从外观无法区分三者,但用X光照射挥发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定,
故答案为:X射线衍射;
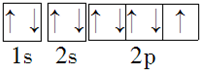
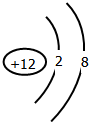
(2)Fe原子序数为26,原子结构中有4个电子层,价电子为3d64s2,铁位于元素周期表中的第四周期第Ⅷ族,Fe3+的电子排布式为1s22s22p63s23p63d5,Fe3+离子3d为半满稳定状态,能量较低,比较稳定;26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,
故答案为:Ⅷ;Fe3+;4;
(3)Al2Cl6结构中黑色球为Al原子、白色球为Cl原子,Al原子与Cl原子之间形成3个共价键、1个配位键,Al原子杂化轨道数目为4,1mol该分子中含2NA个配位键,该分子不是平面型分子,
故答案为:2NA;否;
(4)配位化合物Fe(CO)5,熔点为一20.5℃,沸点为103℃,该物质熔沸点低,易溶于非极性溶剂,属于分子晶体,分子之间存在范德华力,Fe与CO之间形成配位键,CO分子中含有极性键,
故选:BDF;
(5)很多金属盐都可以发生焰色反应,其原因是激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长光的形式将能量释放出来,
故答案为:激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长光的形式将能量释放出来.
点评 本题考查了物质结构与性质的有关知识,涉及晶体、准晶体和非晶体的判别、元素的核外电子排布、双聚物Al2Cl6结构、配位化合物化学键、焰色反应的原因等知识点,题目难度中等,易错点是配位化合物Fe(CO)5晶体中存在的作用力判断.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷可用作燃料,说明甲烷燃烧是释放能量的反应 | |
| B. | 生成物总能量一定低于反应物总能量 | |
| C. | 干冰气化需要吸收大量的热,这个变化是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HCl>H2S>PH3 | B. | 非金属活泼性:S<Cl<P | ||
| C. | 原子半径:Cl>S>P | D. | 原子序数:S<P<Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | HCl | C. | CH3COONa | D. | NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
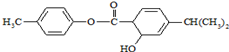
| A. | M中不含手性碳原子 | |
| B. | M中所有碳原子均可能在同一平面 | |
| C. | M可以发生加成、取代、消去等反应 | |
| D. | 1mol M常温下最多可以与3molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室从海带中提取单质碘的方法是取样→灼烧→溶解→过滤→萃取 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| D. | 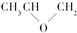 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池负极被氧化 | |
| B. | 任何化学反应都能设计成原电池 | |
| C. | 原电池是一种将化学能转化为电能的装置 | |
| D. | 原电池要使氧化反应和还原反应分别在两个不同的区域进行并形成电流 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式符合CnH2n+2的烃一定是烷烃 | |
| B. | 烷烃均能与氯水发生取代反应 | |
| C. | 正戊烷的熔沸点比乙烷的高 | |
| D. | 烷烃不能被酸性高锰酸钾等强氧化剂氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com