
| A.4种 | B.5种 | C.6种 | D.7种 |
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源:不详 题型:实验题
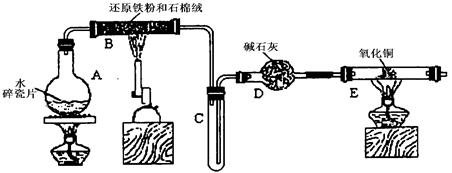
 Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
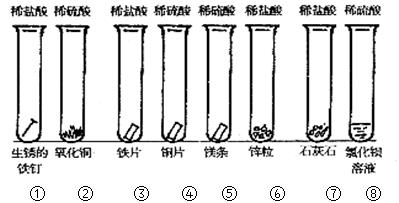
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
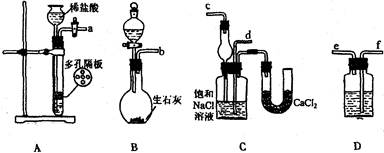
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 骤,请排出正确的操作顺序:
骤,请排出正确的操作顺序:| A.NaOH放在纸上称量,且出现潮解现象 |
| B.配制前容量瓶内已有少量蒸馏水 |
| C.定容时仰视 |
| D.NaOH溶液未经冷却就转移到容量瓶中去 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 、转移、洗涤 ⑤定容、摇匀
、转移、洗涤 ⑤定容、摇匀| A.10ml | B.25ml | C.50ml | D.100ml) |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 现象对所配溶液的浓度有什么影响?(填“偏高”、“偏低”或“无影响”)
现象对所配溶液的浓度有什么影响?(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A | B | C | D |
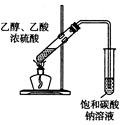 | 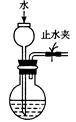 | 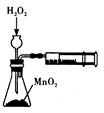 | 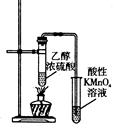 |
| 制取乙酸乙酯 | 检查装置的气密性 | 定量测定 H2O2的分解速率 | 证明 CH3CH2OH 发生消去反应生成了乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com