
【题目】下列溶液中的粒子一定可以大量共存的是
A.加入Al放出H2的溶液:K+、Na+ 、SO![]() 、NO
、NO![]() B.透明溶液:Fe2+、Ba2+、Cl-、NO
B.透明溶液:Fe2+、Ba2+、Cl-、NO![]()
C.遇酚酞变红的溶液:K+、Na+ 、Cl-、HSO![]() D.酸性KMnO4溶液:K+ 、CH3CH2OH、Cl-、SO
D.酸性KMnO4溶液:K+ 、CH3CH2OH、Cl-、SO![]()
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】欲用如图装置对所制备的气体进行除杂、检验,其设计方案合理的是( )
制备气体 | X(除杂试剂) | Y(检验试剂) |
| |
A | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 | |
B | 电石与NaC1水溶液 | H2O | Br2的CCl4溶液 | |
C | C2H5OH与浓硫酸加热至170℃ | 饱和NaHSO3溶液 | K2Cr2O7酸性溶液 | |
D | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是( )

A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液反应,测定中和热。近似认为两溶液的密度都是1g/cm3,实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
中和后生成溶液的比热容c=4.18J/(g·℃),则中和热△H=___(取小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
④H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ 热量
C.氢气的燃烧热为241.8kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO![]() 移向________极(填“正”或“负”),已知CH4发生反应的电极反应式为_____________________________,则另一极的电极反应式为___________________________ 。
移向________极(填“正”或“负”),已知CH4发生反应的电极反应式为_____________________________,则另一极的电极反应式为___________________________ 。
(2)某实验小组同学对电化学原理进行了一系列探究活动。
1)如图为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
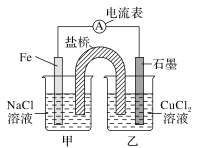
2)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,
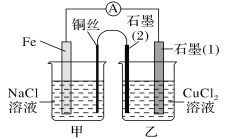
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是________________,电极反应为________________________;乙装置中石墨(1)为________极(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨(2)电极上发生的反应式为________________,产物常用________检验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92g铜粉与一定量的浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况下),则消耗硝酸的物质的量是
A.0.12molB.0.09molC.0.11molD.0.08mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com