
【题目】50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液反应,测定中和热。近似认为两溶液的密度都是1g/cm3,实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
中和后生成溶液的比热容c=4.18J/(g·℃),则中和热△H=___(取小数点后一位)
【答案】-56.8kJ/mol
【解析】
两份溶液中,碱电离产生的OH-过量,所以应使用酸电离产生的H+的物质的量计算生成H2O的物质的量;计算反应的热效应时,混合溶液的质量接近100g,利用公式Q=cmt计算放出的热量,然后换算为生成1mol水放出的热量,即得中和热。
50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液混合,c(OH-)=0.55mol/L,c(H+)=0. 50mol/L,发生反应为H++OH-==H2O,所以OH-过量,生成n(H2O)=0. 50mol/L×0.05L=0.025mol。
四次实验中,第2次实验误差过大,舍去。另三次实验中,温度平均变化值为![]() ℃=3.4℃,Q=cmt=4.18J/(g·℃)×100g×3.4℃×10-3kJ/J=1.42kJ,则中和热△H= -
℃=3.4℃,Q=cmt=4.18J/(g·℃)×100g×3.4℃×10-3kJ/J=1.42kJ,则中和热△H= -![]() = -56.8kJ/mol。答案为:-56.8kJ/mol。
= -56.8kJ/mol。答案为:-56.8kJ/mol。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】氧、硫、硒(Se)、碲(Te)、钋(Po)是元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1)硒在元素周期表中的位置________。
(2)![]() Po的中子数为________。
Po的中子数为________。
(3)某温度时,该族单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
S(g)+H2(g)![]() H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/mol
Se(g)+H2(g)![]() H2Se(g) △H3=+81kJ/mol
H2Se(g) △H3=+81kJ/mol
①硫和硒氢化物的热稳定性:H2S________ H2Se(填“>”、“=”或“<”);判断依据是________。
②写出O2(g)与H2S(g)反应生成H2O(g)和S(g)的热化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
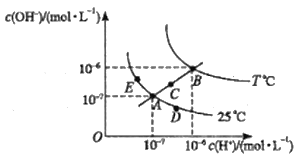
A.图中五点Kw间的关系B>C>A=D=E
B.若从A点到C点,可采用温度不变在水中加入适量的NH4Cl固体
C.若从A点到D点,可采用温度不变在水中加入少量的酸
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸胺(H2NCOONH4)固体,置于特制密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使反应: H2NCOONH4(s)![]() 2NH3(g)+CO2(g)达到分解平衡,实验测得不同温度及反应时间(t1<t2<t3)的有关表格:
2NH3(g)+CO2(g)达到分解平衡,实验测得不同温度及反应时间(t1<t2<t3)的有关表格:
氨基甲酸铵分解时温度、气体总浓度及反应时间的关系。
温度/℃ 气体总浓度(mol/L) 时间/min | 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
(1)在25℃,0-t1时间内产生氨气的平均速率为___。
(2)根据表中数据换算出,15℃时合成反应2NH3(g)+CO2(g)![]() H2NCOONH4(s)平衡常数K约为___。
H2NCOONH4(s)平衡常数K约为___。
(3)以捕捉到的CO2与H2为原料可合成甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)![]() CH3OH(g)+H2(g) ΔH<0在恒温恒容的密闭容器中,加入1molCO2和3molH2,充分反应达平衡时放出热量akJ,若在原容器中加入2molCO2和6molH2,在相同温度下反应达平衡时放热bkJ,则a和b满足的关系___。
CH3OH(g)+H2(g) ΔH<0在恒温恒容的密闭容器中,加入1molCO2和3molH2,充分反应达平衡时放出热量akJ,若在原容器中加入2molCO2和6molH2,在相同温度下反应达平衡时放热bkJ,则a和b满足的关系___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的粒子一定可以大量共存的是
A.加入Al放出H2的溶液:K+、Na+ 、SO![]() 、NO
、NO![]() B.透明溶液:Fe2+、Ba2+、Cl-、NO
B.透明溶液:Fe2+、Ba2+、Cl-、NO![]()
C.遇酚酞变红的溶液:K+、Na+ 、Cl-、HSO![]() D.酸性KMnO4溶液:K+ 、CH3CH2OH、Cl-、SO
D.酸性KMnO4溶液:K+ 、CH3CH2OH、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纤维素乙醇燃料是一种绿色、可再生的新能源,利用地球上广泛存在的纤维素质生物原料生产清洁的乙醇燃料制成燃料电池。下图是绿色电源“乙醇燃料电池”的工作原理示意图(a、b均为多孔性石墨电极)。该电池工作时,下列说法错误的是
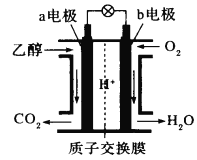
A.该电池工作时是把化学能转化为电能B.H+通过质子交换膜从a极区移向b极区
C.a电极反应式为C2H5OH-12e- +16OH-=2CO![]() +11H2OD.电池工作时,消耗标准状况下6.72LO2,外电路中转移电子数为1.2NA
+11H2OD.电池工作时,消耗标准状况下6.72LO2,外电路中转移电子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是

A. 干燥管b中装入碱石灰
B. Q气球中产生的气体主要成份O2、CO2
C. 测定气体总体积必须关闭K1、K2,打开K3
D. 读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟合成氨和氨催化氧化的流程如下:
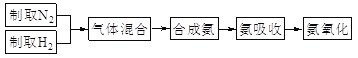
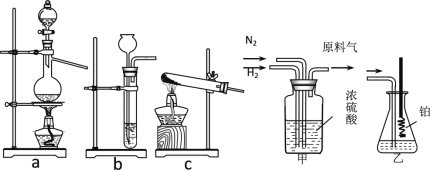
已知:实验室用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气__、氢气___。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有__、_。
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:_,锥形瓶中还可观察到的现象是:____。
(4)写出乙装置中氨氧化的化学方程式:_____。
(5)反应结束后锥形瓶内的溶液中含有H+、OH-、_、_离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com