
【题目】通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是

A. 干燥管b中装入碱石灰
B. Q气球中产生的气体主要成份O2、CO2
C. 测定气体总体积必须关闭K1、K2,打开K3
D. 读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】芳香族化合物 A(C9H12O)常用于药物及香料的合成,A 有如下转化关系:
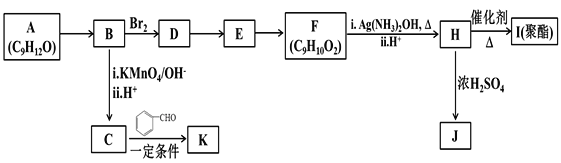
已知以下信息:
①A不能使酸性高锰酸钾溶液褪色;
②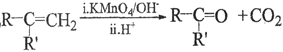
③![]()
回答下列问题:
(1)A生成B的反应条件为:____________,由D生成E的反应类型为____________。
(2)F所含官能团的结构简式为___________________ 。
(3)K的分子式为_________,由H生成I的反应方程式为______________________________。
(4)J为一种具有3个六元环的酯,则其结构简式为______________________。
(5)F的同分异构体中,属于芳香族化合物且能与NaHCO3反应生成CO2的有____种,其中核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的为_________________________写出其中一种结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是___________(填序号)。
a. Ba(OH)2·8H2O与NH4Cl混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
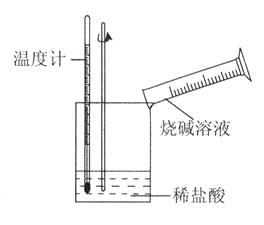
②某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是_______(填“吸热”或“放热”)反应,其离子方程式是_______________。
(2)电能是现代社会应用最广泛的能源之一。
下图所示的原电池装置中,其负极是_____________________,正极上能够观察到的现象是____________________________,正极的电极反应式是_________________________。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。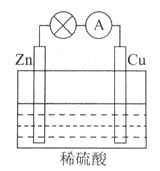
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由配位键形成的离子[Pt(NH3)6]2+和[PtCl4]2—中,两个中心离子铂的化合价是( )
A.都是+8 B.都是+6 C.都是+4 D.都是+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示反应M(g)+P(g) ![]() nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的点表示平衡状态)。下列有关该反应的描述错误的是( )
nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的点表示平衡状态)。下列有关该反应的描述错误的是( )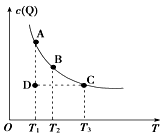
A.通过分析题图,该反应的正反应为放热反应
B.A状态与C状态的化学反应速率比较为v(A)<v(C)
C.在T1、D状态时,v正<v逆
D.在T2、B状态时,改变体积始终有v正=v逆 , 则n=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是;
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃,某时刻各物质浓度符合下式:2[c(CO2)c(CH2)]=3[c(CO)c(H2O)],试试判此时v正v逆。(大于,小于或者等于)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是( )
A.二氧化硅可用于制造光导纤维
B.石英玻璃可用于制造光学仪器
C.玻璃在加热融化时有固定的熔点
D.制普通玻璃的原料是纯碱、石灰石、石英
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com