
【题目】相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )
①它们所含的分子数目之比为1:1
②它们所含的氧原子数目之比为1:2
③它们所含的原子总数目之比为2:3
④它们所含的碳原子数目之比为1:1
A. ①和④ B. ②和③ C. ④ D. ①②③④
科目:高中化学 来源: 题型:
【题目】根据水溶液中离子平衡的知识回答下列问题:
I.已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,则
(1)该溶液中c (H+)=________,HA的电离平衡常数Ka=________;
(2)由HA电离出的c(H+)约为水电离出的c (H+)的________倍。
II.常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同,则:B是________,C是________。常温下若B溶液中c(OH-)与C溶液中c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc=________(填某个数)。
III.将pH=1的稀硫酸慢慢加入一定量的BaCl2溶液中,恰好使Ba2+沉淀完全时溶液的体积为100 mL(混合时溶液体积变化忽略不计),溶液的pH=2,则原BaCl2 溶液中Cl-的浓度为 mol/L。(结果保留两.位.有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200 oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O, 电池示意如右图,下列说法不正确的是:

A.b极为电池的正极
B.电池正极的电极反应为:4H+ + O2 + 4e- =2H2O
C.电池工作时电子由b极沿导线经灯泡再到a极
D.电池工作时,1mol乙醇被氧化时就有12mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国古代的四大发明之一,距今已有1000多年的历史,其成分是木炭(C)、硫粉(S)和硝酸钾(KNO3)。回答下列有关问题:
(1)黑火药爆炸生成无毒的气体和K2S,该反应的化学方程式为________________。
(2)Se与S同主族,则Se原子的核外电子排布式为〔Ar〕________,有____对成对电子。
(3)C、N、O、K的电负性由大到小的顺序是_________________。
(4) 黑火药爆炸除生成K2S外,还生成少量K2S2,其结构类似于Na2O2。则K2S2中含有的化学键类型为_______________。
(5) K2S遇酸生成H2S,H2S分子中,S原子的杂化轨道类型是_________;KNO3可电离出NO3-,NO3-的空间构型是______________。
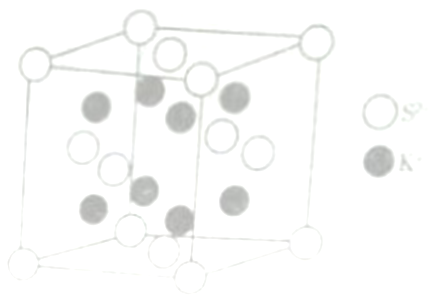
(6) K2S的晶胞结构如右图所示。其中K+的配位数为_______,若K2S晶体的密度为ρg·cm-3,则晶胞中距离最近的两个S2-核间距为_________cm(用NA表示阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种带有多孔结构的镍铝合金对H2具有较强的吸附性,其高催化活性和热稳定性使得该镍铝合金被用于很多工业过程中和有机合成反应中。下图是以镍黄铁矿(主要成分为NiS、FeS等)为原料制备该镍铝合金的工艺流程图:

回答下列问题:
(1)Ni(CO)4中C、O化合价与CO中的C、O化合价相同,则Ni化合价为_______价。
(2)在空气中“煅烧”生成Ni2O3和Fe2O3,写出Fe2O3的化学方程式________________。
(3)操作“镍![]() Ni(CO)4
Ni(CO)4![]() 镍”的目的是__________。
镍”的目的是__________。
(4) Ni、Al高温熔融时,气体x的作用是___________。对“高温熔融”物冷却后,需要进行粉碎处理,粉碎处理的目的是________________。
(5)“碱浸”可以使镍产生多孔结构,从而增强对H2的吸附性,“浸出液”中的主要离子是_____________;“浸出液”中的铝元素可循环利用,写出回收“浸出液”中的铝元素,并制备“高温熔融”时的原料Al的流程:_____________(示例:CuO![]() Cu2+
Cu2+![]() Cu)。
Cu)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)纯水在T ℃时pH=6,该温度下1 mol/L的NaOH溶液中,由水电离出的c(OH-)= mol/L。
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A) pH(B) (填“>”、“=”或“<”);现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A) V(B)(填“>”、“=”或“<”)。
(3)已知:二元酸H2R 的电离方程式是:H2R=H++HR﹣,HR﹣![]() R2﹣+H+,若0.1molL﹣1NaHR溶液的c(H+)=a molL﹣1,则0.1molL﹣1H2R溶液中c(H+) (0.1+a) molL﹣1(填“<”、“>”或“=”),理由是 。
R2﹣+H+,若0.1molL﹣1NaHR溶液的c(H+)=a molL﹣1,则0.1molL﹣1H2R溶液中c(H+) (0.1+a) molL﹣1(填“<”、“>”或“=”),理由是 。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH[] | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃1体积只能与1体积氯气发生加成反应,生成氯代烷烃,此氯代烷烃1mol可与4mol氯气发生完全的取代反应,则该烃的结构简式为( )
A.CH2═CH2
B.CH3CH═CH2
C.CH3CH3
D.CH2═CHCH═CH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com