
����Ŀ����ش��������⣺
��1����ˮ��T ��ʱpH��6�����¶���1 mol/L��NaOH��Һ�У���ˮ�������c(OH��)�� mol/L��
��2��ijһԪ������Һ(A)���Ԫǿ��(B)��pH��ȡ���������Һϡ����ͬ�ı�����pH(A) pH(B) (���������=������)����������ϡ����Һ�к͵�Ũ�ȵ������NaOH��Һ������ϡ����Һ�����V(A) V(B)(���������=������)��
��3����֪����Ԫ��H2R �ĵ��뷽��ʽ�ǣ�H2R=H++HR����HR��![]() R2��+H+����0.1molL��1NaHR��Һ��c(H+)=a molL��1����0.1molL��1H2R��Һ��c(H+) (0.1+a) molL��1(���������������=��)�������� ��
R2��+H+����0.1molL��1NaHR��Һ��c(H+)=a molL��1����0.1molL��1H2R��Һ��c(H+) (0.1+a) molL��1(���������������=��)�������� ��
��4������ƽ�ⳣ���Ǻ���������ʵ���̶ȵ�����������֪��
��ѧʽ | ���볣��(25 ��) |
HCN | K��4.9��10��10 |
CH3COOH[] | K��1.8��10��5 |
H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
��25 ��ʱ���е�Ũ�ȵ�HCN��Һ��H2CO3��Һ��CH3COOH��Һ������Һ��pH�ɴ�С��˳��Ϊ________(�û�ѧʽ��ʾ)��
����NaCN��Һ��ͨ��������CO2��������Ӧ�Ļ�ѧ����ʽΪ__________________��
���𰸡���1��10��12(2��)��2����(1��)��(1��)
��3����(1��)H2R�е�һ���������H+��HR���ĵ����������������(2��)
��4����H2CO3>HCN>CH3COOH(1��)��NaCN��H2O��CO2=HCN��NaHCO3(2��)
��������
���������
��1����ˮ��T ��ʱ��pH��6����c(H��)��c(OH��)��10��6����֪Kw��10��12��1 mol��L��1��NaOH��Һ����ˮ�������c(OH��)ȡ������Һ�е�c(H��)����c(OH��)ˮ������c(H��)��10��12 mol��L��1��
��2��ǿ��ÿϡ��10n����pH������n����λ������ÿϡ��10n����pH����n����λ����������Һϡ����ͬ�ı�����pH(A)<pH(B)��һԪ������Һ(A)���Ԫǿ��(B)��pH��ȣ�˵�������Ũ��Զ����ǿ���Ũ�ȣ�A�������ӵ����ʵ���Զ����B�������ӵ����ʵ���������������ϡ����Һ�к͵�Ũ�ȵ������NaOH��Һ������ϡ����Һ�����V(A) ��V(B)��
��3���ɶ�Ԫ��H2R �ĵ��뷽��ʽ�ǣ�H2R=H++HR-��HR-![]() R2- + H+����֪��0.1 mol��L-1NaHR��Һ��ֻ����HR-�ĵ��룬c(H+)=a mol��L-1����0.1mol��L-1H2R��Һ�д����������룬��һ���������H+��HR-�ĵ���������������ã�����c(H+)<(0.1+a) mol��L-1��
R2- + H+����֪��0.1 mol��L-1NaHR��Һ��ֻ����HR-�ĵ��룬c(H+)=a mol��L-1����0.1mol��L-1H2R��Һ�д����������룬��һ���������H+��HR-�ĵ���������������ã�����c(H+)<(0.1+a) mol��L-1��
��4��ǿ�������ζ�Ӧ���������Խ������ˮ��̶Ⱦ�Խ��pHԽ������ĵ���ƽ�ⳣ��ԽС������Na2CO3��Ӧ����K2��5.6��10��11��H2CO3��K1����K(HCN)��K2С��K(HCN)�������NaCN��Һ��ͨ��������CO2������Ӧ��NaHCO3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƿ������ڸ��Ƶر�ˮ�ʡ��������ؽ������ӷ�ˮ�������ೱ��Ҳ������Ӧ�������ȡ�ʵ���ҿ��ù�ҵ̼���(��MgCO3��FeCO3������)��ȡ������̼��ƣ�Ȼ�����ô���̼�����ȡ�������ƣ�����Ҫ�������£�

��֪��CaO2��8H2O�ʰ�ɫ����ˮ��
(1)д����Ӧ����������ԭ��Ӧ�����ӷ���ʽ�� ______________��
(2)��Ӧ�ٺ����Һ�м�Ũ��ˮ��Ŀ���ǣ� __________________��
(3)��Ӧ�ڳ��ñ�ˮ�����¶���0�����ң������ԭ����(д������)��
��__________________����______________��
(4)�ⶨ��Ʒ��CaO2�ĺ�����ʵ�鲽����
��һ����ȷ��ȡa g��Ʒ��������ƿ�У�������������ˮ������b g KI���壬�ٵ�������2 mol/L��H2SO4��Һ����ַ�Ӧ��
�ڶ�������������ƿ�м��뼸�ε�����Һ��
����������ε���Ũ��Ϊc mol��L��1��Na2S2O3����Һ����Ӧ�յ㣬����Na2S2O3��ҺV mL��
��֪��I2��2S2O![]() ===2I����S4O
===2I����S4O![]() ��
��
�ٵζ��յ������Ϊ____________����Ʒ��CaO2����������Ϊ_________________
��ijͬѧ��һ���͵ڶ����IJ������ܹ淶������������̫����������õ�CaO2��������������________ (�����Ӱ�족��ƫ�͡���ƫ�ߡ�)��ԭ����_____________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������ʹ���Ը��������Һ��ɫ����ѧ��Ӧ����ʽΪ��
5SO2 + 2KMnO4 + 2H2O �� K2SO4 + 2MnSO4 + 2H2SO4
����ͼװ������֤Ũ������ľ̿�ڼ��������·�Ӧ�IJ����к���SO2��CO2��������ͼ���и�װ�����һ��ʵ�飬����֤������Ӧ�������ĸ��ֲ��
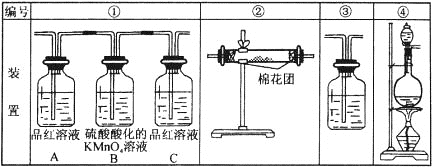
��1����Щװ�õ�����˳���ǣ������������������ҵķ�����дװ�õı�ţ���______��____��____��____��
��2��ʵ��ʱ�ɹ۲쵽װ�â���Aƿ����Һ��ɫ��Aƿ��Һ��������_________��Bƿ��Һ��������_______�� Cƿ��Һ��������________________��
��3��װ�â������ӵĹ���ҩƷ��____________������֤�IJ�����____________��
��4��װ�â�����ʢ��Һ��_____________������֤�IJ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijЩ���ӵļ��鼰����һ����ȷ����
A. ����ϡ���������ɫ���壬������ͨ�����ʯ��ˮ����Һ����ǣ�һ����CO![]()
B. ���������ữ���Ȼ�������Һ���а�ɫ������������Һ�в�һ����SO![]()
C. ��������������Һ�����ȣ�������������ʹʪ���ɫʯ����ֽ������һ����NH4+
D. ����̼������Һ������ɫ�������ټ������ɫ������ʧ��һ����Ba2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����CO��CO2��Ƚϣ������й���������ȷ���ǣ� ��
�����������ķ�����Ŀ֮��Ϊ1:1
��������������ԭ����Ŀ֮��Ϊ1:2
������������ԭ������Ŀ֮��Ϊ2:3
������������̼ԭ����Ŀ֮��Ϊ1:1
A. �ٺ͢� B. �ں͢� C. �� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL 0.50 mol/L ��������50 mL 0.55mol/L������������Һʹ��ʹ������װ�ý����к��Ȳⶨʵ����
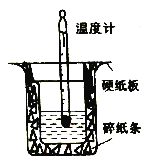
��1��װ����ȱ�ٵ�һ��������_____��װ���л����ڵĴ�����_______�����ִ�����������¶ȶ���_______������ƫ��������ƫС��������Ӱ����) ��
��2���ɷ�ȡ��55mL 0.50mol/L , NaOH ��Һ�ִ�50 mL 0.55m ѵL ������������Һ��____��������������������������
��3����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50mL������¼����ԭʼ������
ʵ����� | ���� ��ʼ�¶�t1/�� | ��ֹ�¶ȣ�t2���� | �²t2-t1���� | ||
���� | NaOH��Һ | ƽ��ֵ | |||
1 | 25.1 | 24.9 | 28.2 | ||
2 | 25.1 | 25.1 | 28.4 | ||
3 | 25.1 | 25.1 | 28.5 | ||
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.0g/cm3���кͺ���Һ�ı����� C=4.2J/(g����)��ʽ��������÷�Ӧ���к���Ϊ��H=_____________________��������������С�����1λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к���HCO3-��CO32-��SO32-��Na+��NO3-�������ӣ��������м���Na2O2��ĩ�����ַ�Ӧ����Һ������Ũ�ȱ��ֲ�����ǣ���Һ����仯���Բ��ƣ�
A. CO32- NO3- Na+ B. CO32- NO3- C. SO32- NO3- D. NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�п��ܺ������м��������е�ij���֣�Ca2+��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��Cu2+��Ϊȷ����Һ��ɽ�������ʵ�飺��1��200mL������Һ����������
��Cu2+��Ϊȷ����Һ��ɽ�������ʵ�飺��1��200mL������Һ����������![]() ��Һ����Ӧ�������ˡ�ϴ�ӡ�����ó���4.30g,������м�����������ᣬ��2.33g�������ܡ���2����1������Һ�м���������
��Һ����Ӧ�������ˡ�ϴ�ӡ�����ó���4.30g,������м�����������ᣬ��2.33g�������ܡ���2����1������Һ�м���������![]() ��Һ�����ȣ������ܴ�ʹʪ���ɫʯ����ֽ����������1.12L���ѻ���ɱ�״�����ٶ�����������ȫ���ݳ������ɴ˿��Եó�����ԭ��Һ��ɵ���ȷ������
��Һ�����ȣ������ܴ�ʹʪ���ɫʯ����ֽ����������1.12L���ѻ���ɱ�״�����ٶ�����������ȫ���ݳ������ɴ˿��Եó�����ԭ��Һ��ɵ���ȷ������
(1)��Һ��һ�������ڵ�������__������ȷ���Ƿ���ڵ�������__��Ϊȷ�������ӣ�Ӧ�������ʵ��������______________
(2)��Һ�п϶����ڵ�����������Щ��ͨ������������ǵ����ʵ���Ũ�ȣ���Χ����______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������˳����ȷ���ǣ� ��
A.ԭ�Ӱ뾶���ƣ�����
B.�����ԣ�Na+��K+
C.��������ϼۣ��ȣ�����
D.���ԣ�HF��HCl��HBr
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com