
����Ŀ����50mL 0.50 mol/L ��������50 mL 0.55mol/L������������Һʹ��ʹ������װ�ý����к��Ȳⶨʵ����
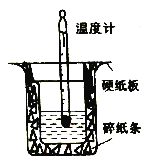
��1��װ����ȱ�ٵ�һ��������_____��װ���л����ڵĴ�����_______�����ִ�����������¶ȶ���_______������ƫ��������ƫС��������Ӱ����) ��
��2���ɷ�ȡ��55mL 0.50mol/L , NaOH ��Һ�ִ�50 mL 0.55m ѵL ������������Һ��____��������������������������
��3����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50mL������¼����ԭʼ������
ʵ����� | ���� ��ʼ�¶�t1/�� | ��ֹ�¶ȣ�t2���� | �²t2-t1���� | ||
���� | NaOH��Һ | ƽ��ֵ | |||
1 | 25.1 | 24.9 | 28.2 | ||
2 | 25.1 | 25.1 | 28.4 | ||
3 | 25.1 | 25.1 | 28.5 | ||
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.0g/cm3���кͺ���Һ�ı����� C=4.2J/(g����)��ʽ��������÷�Ӧ���к���Ϊ��H=_____________________��������������С�����1λ��
���𰸡� ���β�������� ��С�ձ���δƽ�� ƫС ���� ![]() KJ/mol=-55.4KJ/mol
KJ/mol=-55.4KJ/mol
��������(1)װ����ȱ�ٵ�һ�������ǻ��β����������װ���л����ڵĴ����д�С�ձ���δƽ�룬���ִ�����������ɢʧ����������¶ȶ���ƫС��
(2)�к�����ʹ��������������أ�����ֻ�м����������HCl�����ʵ�����ȷ��������ȫ��Ӧ���ɣ��������55mL 0.50mol/L NaOH ��Һ����50 mL 0.55mol/L ������������Һ��
(3)��1��ʵ�鷴Ӧǰ���¶Ȳ�Ϊ��3.2�棻��2�η�Ӧǰ���¶Ȳ�Ϊ��3.3�棻��3��ʵ�鷴Ӧǰ���¶Ȳ�Ϊ��3.4�棬����Ч��ƽ��ֵΪ3.3�棬
0.55mol/L��NaOH��Һ50mL��0.50mol/L������50mL��������m=100mL��1g/mL=100g��c=4.2J/(g��)�����빫ʽQ=cm��T������0.025mol��ˮ�ų�����Q=4.2J/(g��)��100g��3.3��=1386J=1.386KJ��������0.025mol��ˮ�ų�����1.386KJ����������1mol��ˮ�ų�����Ϊ![]() =55.4kJ������ʵ���õ��к��ȡ�H=-55.4kJ/mol��
=55.4kJ������ʵ���õ��к��ȡ�H=-55.4kJ/mol��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ΪV L�ĺ����ܱ�������ʢ��һ����H2��ͨ��Br2(g)������ӦH2(g)+Br2(g)![]() 2HBr(g)����H��0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����仯��ϵ��ͼ��ʾ������˵����ȷ����
2HBr(g)����H��0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����仯��ϵ��ͼ��ʾ������˵����ȷ����

A����b��c�����ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2
B��a��b����ķ�Ӧ���ʣ�b��a
C��Ϊ�����Br2(g)��ת���ʿɲ�ȡ����Br2(g)ͨ�����ķ���
D��b��c�����HBr���������b��c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þȼ�ϵ����Ϊһ�ָ��ܻ�ѧ��Դ�����б������ߡ�ʹ�ð�ȫ���㡢�ɱ��͡�ȼ���������ˡ���ȾС���ص㣬ӵ�����õ�Ӧ��ǰ������ͼ��þȼ�ϵ�ص�һ��ԭ��ͼ����װ��ΪԲͲ״��������Ϊþ����ԲͲΪ�����ĵ�����ϡ������йظ�þȼ�ϵ�ص�������ȷ����
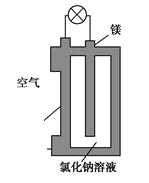
A. �õ�ص��ܷ�ӦΪ2Mg+O2=2MgO
B. ��Ӧ����O2-������������������
C. Cl-������ʧȥ��������Cl2
D. ������ӦʽΪO2+2H2O+4e-=4OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ˮ�������е����ã�����˵������ȷ���� �� ��
A��ˮ����һ�ֺܺõ��ܼ� B��ˮ�������ڻ��е������µ�����
C������ˮԽ����Խ�� D��û����Ⱦ��ˮ���Ǵ���ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��������⣺
��1����ˮ��T ��ʱpH��6�����¶���1 mol/L��NaOH��Һ�У���ˮ�������c(OH��)�� mol/L��
��2��ijһԪ������Һ(A)���Ԫǿ��(B)��pH��ȡ���������Һϡ����ͬ�ı�����pH(A) pH(B) (���������=������)����������ϡ����Һ�к͵�Ũ�ȵ������NaOH��Һ������ϡ����Һ�����V(A) V(B)(���������=������)��
��3����֪����Ԫ��H2R �ĵ��뷽��ʽ�ǣ�H2R=H++HR����HR��![]() R2��+H+����0.1molL��1NaHR��Һ��c(H+)=a molL��1����0.1molL��1H2R��Һ��c(H+) (0.1+a) molL��1(���������������=��)�������� ��
R2��+H+����0.1molL��1NaHR��Һ��c(H+)=a molL��1����0.1molL��1H2R��Һ��c(H+) (0.1+a) molL��1(���������������=��)�������� ��
��4������ƽ�ⳣ���Ǻ���������ʵ���̶ȵ�����������֪��
��ѧʽ | ���볣��(25 ��) |
HCN | K��4.9��10��10 |
CH3COOH[] | K��1.8��10��5 |
H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
��25 ��ʱ���е�Ũ�ȵ�HCN��Һ��H2CO3��Һ��CH3COOH��Һ������Һ��pH�ɴ�С��˳��Ϊ________(�û�ѧʽ��ʾ)��
����NaCN��Һ��ͨ��������CO2��������Ӧ�Ļ�ѧ����ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ڵij�ʽԪ�����ڱ���˵������ȷ���ǣ� ��
A.�������������������Ǣ�A��
B.�߸�����18����
C.��A��ȫ���ǽ���Ԫ��
D.����Ԫ�������������Ǣ�B��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������FeCO3������þ�����Ҫ�ɷ֣���FeCO3���ȵ�200�濪ʼ�ֽ�ΪFeO��CO2�����ڿ����и�������FeCO3����Fe2O3��
I����֪25�棬101kPaʱ��4Fe(s)+3O2(g)=2Fe2O3(s) ��H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) ��H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) ��H=+148OkJ/mol
��1����д��FeCO3�ڿ�������������Fe2O3���Ȼ�ѧ����ʽ_______��
�����ɵ�FeO��Fe2O3��һ�������±���ԭΪ��������
��2���ݱ���һ��������Fe2O3�ɱ����黹ԭΪ���������Ľ��������䷴ӦΪ��
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) ��H>0
�� ԭ������Ϊ26����Ԫ��λ��Ԫ�����ڱ��ĵ�_______���ڡ�
�ڷ�Ӧ��5L���ܱ������н��У�2min��ﵽƽ�⣬���Fe2O3�ڷ�Ӧ����������4.8g����ö�ʱ������H2�����ƽ����Ӧ����Ϊ____________��
�۽�һ������Fe2O3(s)��һ������CH4(g)���ں��º�ѹ�����У���һ�������·�Ӧ���ܱ����÷�Ӧ�ﵽƽ��״̬����___________��
a.CH4��ת���ʵ���CO�IJ��� b����������ƽ����Է�����������
c.v��(CO)��v��(H2)=1:2 d.���������������
��3��FeO����CO���л�ԭ����֪��t��ʱ��FeO(s)+CO(g)![]() Fe(s)+CO2(g)��K=0.5������1L�ܱ������м���0.04mol FeO(s)����ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO(s)��ת����Ϊ50%����x=_______��
Fe(s)+CO2(g)��K=0.5������1L�ܱ������м���0.04mol FeO(s)����ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO(s)��ת����Ϊ50%����x=_______��
��. Fe2O3���������Ʊ�FeCl3��FeCl3��ˮ��Һ�е�ˮ���������
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O![]() Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
��4������ˮ�ⷴӦ��ƽ�ⳣЧK1��K2��K3�ɴ�С��˳����_______��ͨ����������������ˮ�����ۺ����ɾۺ�������ӷ���ʽΪ��xFe3++yH2O===Fex(OH)y(3x-y)++yH+
��ʹƽ�������ƶ��ɲ��õķ�����__________������ĸ��
a����ˮϡ�� b����������NaCl���� c������ d����������Na2CO3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ù���NaOH�������ʵ���Ũ����Һʱ�����в����ᵼ����ҺŨ��ƫ�ߵ��ǣ� ��
A. ���ձ����ܽ�ʱ��������Һ�彦�� B. ��Ʒ�к�������Na2O����
C. ����ƿʹ��ǰδ���� D. ����ʱ����������ƿ�̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о������ĸ�ʴ������������ͼ��ʾװ�á�������������ȷ���ǣ�

A����XΪ̼����Ϊ�������ĸ�ʴ������KӦ����N��
B����XΪ̼��������K����M������ӿ����ĸ�ʴ
C����XΪп������K����M����������������������������
D����XΪп������K����N�������缫�����ķ�ӦΪFe-2e- =Fe3+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com