
| A、CO2分子内含有极性键,所以CO2分子是极性分子 |
| B、气态氢化物的稳定性:NH3>PH3>AsH3 |
| C、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键 |
| D、某非金属元素从游离态变成化合态时,该元素一定被还原 |


科目:高中化学 来源: 题型:
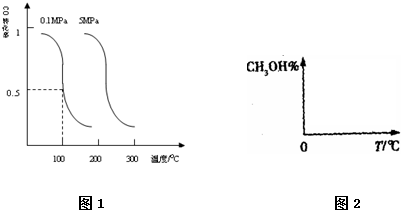
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其转移电子0.5 mol |
| B、生成Cl2 0.5 mol |
| C、参加反应的HCl为16 mol |
| D、Cl2是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液中加过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
| B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| C、氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |
| D、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、把金属Na投入CuSO4溶液中:2Na+Cu2++SO
| ||||
B、向AlCl3溶液中滴加浓氨水至过量:Al3++4NH3?H2O=AlO2-+4NH
| ||||
C、向NaHSO4溶液中加入过量的Ba(OH)2溶液:Ba2++OH-+H++SO
| ||||
D、在稀硝酸中加入少量的铁粉:3Fe+8H++2NO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BOH是一元强碱 |
| B、混合后,HA的电离百分数仍为10% |
| C、混合溶液中[A-]>[B+] |
| D、[H+]与[A-]之比值,原HA溶液大于混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、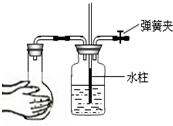 装置可用于检查气密性 |
B、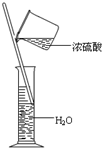 装置可用来配制稀硫酸 |
C、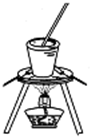 装置可用于实验室从食盐水中提取氯化钠 |
D、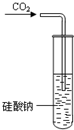 装置可用于证明酸性:H2CO3<H2SiO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com