


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| ||
| (6-10)×105Pa |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
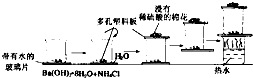 某同学设计如图的实验方案来探究NH4Cl和Ba(OH)2?8H2O反应中的能量变化.根据他的实验步骤填写对应的实验现象和结论.
某同学设计如图的实验方案来探究NH4Cl和Ba(OH)2?8H2O反应中的能量变化.根据他的实验步骤填写对应的实验现象和结论.| 实验步骤 | 实验现象 | 得出结论 |
| A.将晶体混合后立即用玻璃棒快速搅拌混合物,并在烧杯口放一湿润的红色石蕊试纸 | ||
| B.用手触摸烧杯下部 | ||
| C.用手拿起烧杯 | ||
| D.将粘有玻璃片的烧杯放在盛有热水的烧杯上一会儿再拿起 | ||
| E.反应完后移走烧杯上的多孔塑料板,观察反应物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2分子内含有极性键,所以CO2分子是极性分子 |
| B、气态氢化物的稳定性:NH3>PH3>AsH3 |
| C、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键 |
| D、某非金属元素从游离态变成化合态时,该元素一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、热化学方程式C2H2(g)+
| ||
| B、H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | ||
| C、少量的钠投入足量的水中:2Na+2H2O═2Na++2OH-+H2↑ | ||
| D、向明矾KAl(SO4)2溶液中滴入氢氧化钡溶液,至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com