
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
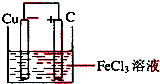 ,负极反应式为,正极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),
,负极反应式为,正极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+), ;
;

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、①②④ |
| C、①③④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 分类的标准 | 单独属于一类的物质 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 | ||
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、把金属Na投入CuSO4溶液中:2Na+Cu2++SO
| ||||
B、向AlCl3溶液中滴加浓氨水至过量:Al3++4NH3?H2O=AlO2-+4NH
| ||||
C、向NaHSO4溶液中加入过量的Ba(OH)2溶液:Ba2++OH-+H++SO
| ||||
D、在稀硝酸中加入少量的铁粉:3Fe+8H++2NO
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com