
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示(明矾石焙烧后成分不变):
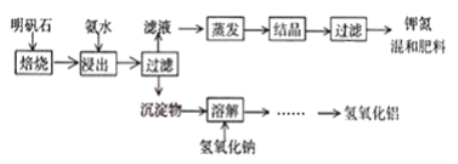
完成下列填空:
(1)“浸出”反应的离子方程式为_______。“浸出”所用稀氨水浓度为39.20g/L,配制500mL该氨水需251.28g/L的浓氨水________mL。
(2)“过滤”所需的玻璃仪器有______________。
(3)写出“溶解”过程中发生反应的化学方程式_________、________。
(4)检验滤液中是否含有SO42-的实验方法__________。
(5)为测定钾氨复合肥K2SO4、(NH4)2SO4中SO42-的质量分数,设计实验步骤如下:
①_____________________。
②溶于水,加入足量BaCl2溶液,待白色沉淀不再产生为止。
③过滤、______、________(依次填写实验操作名称)。
④冷却、称量所得沉淀的质量。
(6)若所取试样和所得沉淀的质量分别为mg、ng,试用含有m、n的代数式表示该钾氮复合肥中SO42-的质量分数为________。
【答案】Al3++3NH3·H2O→Al(OH)3↓+3NH4+ 78 烧杯、玻璃棒、漏斗 Al(OH)3+NaOH→NaAlO2+2H2O Al2O3+2NaOH→2NaAlO2+H2O 取少量滤液,向其中滴加稀盐酸,无明显现象,再向其中滴加BaCl2溶液,有沉淀生成则说明滤液中含有SO42-,反之则无 取样,称量样品的质量 洗涤 干燥 96n/233m
【解析】
(1).明矾成分为十二水硫酸铝钾,明矾石焙烧后加氨水浸出,生成Al(OH)3沉淀,反应离子方程式为:Al3++3NH3·H2O→Al(OH)3↓+3NH4+;设需要浓氨水xmL,则![]() ,解得x=78mL;
,解得x=78mL;
(2). “过滤”所需的玻璃仪器有烧杯、玻璃棒、漏斗;
(3).“溶解”过程为氢氧化铝沉淀在氢氧化钠溶液中溶解,方程式为:Al(OH)3+NaOH→NaAlO2+2H2O,明矾石中含有氧化铝在氢氧化钠溶液中溶解,方程式为:Al2O3+2NaOH→2NaAlO2+H2O;
(4).以硫酸钡白色沉淀的生成来检验硫酸根离子,取少量溶液与试管中,先加入盐酸酸化,再加入BaCl2,若产生白色沉淀则说明滤液中含有SO42-,反之则无;
(5).试验的第一步为取样,称取一定质量的样品;生成沉淀后对沉淀进行洗涤,且干燥沉淀,冷却后称取质量。
(9).硫酸根的物质的量为:n/233,则样品中SO42-的质量分数为98n/m233;


科目:高中化学 来源: 题型:
【题目】FeCl2是一种用途广泛的化工产品。由于在水溶液中难以得到高纯度的FeCl2,某课题小组设计氯化铁和氯苯反应制得高纯度的FeCl2。
(查阅资料)①在加热条件下,氯化铁遇水剧烈水解。
②2FeCl3 +C6H5Cl →C6H4Cl2 + 2FeCl2 + HCl↑
③有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2(对二氯苯) | FeCl3 | FeCl2 | |
式量 | 112.5 | 147 | 162.5 | 127 |
溶解性 | 不溶于水,易溶于苯 | 溶于水,不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | —— | —— |
沸点/℃ | 132 | 173 | —— | —— |
(实验过程)按下图装置,在三颈烧瓶中放入a g无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯A中物质得到产品。
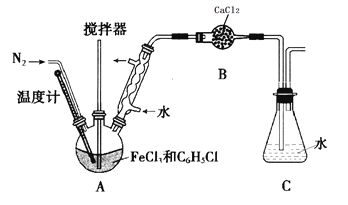
回答下列问题:
(1)实验装置中,仪器B的名称是________________。
(2)反应前后都需要通入N2的目的是_____________。
(3)实验过程中控制反应温度128~139℃,C6H5Cl不会有明显损失,原因是_____________。
(4)充分反应后,冷却。对三颈烧瓶内的物质进行过滤,用苯洗涤沉淀,干燥得到产品。回收滤液中C6H5Cl的方案为_______________。
(5)经检验产品中不含有FeCl3。取少量所得产品溶解于盐酸中,配制成溶液。向盛有H2O2溶液的试管中加入几滴配制的溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__________;生成沉淀的原因是(用平衡移动原理解释)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是

A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。下列说法错误的是

A. ②的作用是安全瓶
B. ③中试剂更换为Ba(NO3)2后,无明显现象发生
C. ④中的现象说明SO2具有氧化性
D. ⑤用于检验SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组进行如下实验测定 H2C2O4·xH2O 中 x 值已知:M(H2C2O4)=90gmol-1
① 称取1.260 g 纯草酸晶体,将草酸制成 100.00 mL 水溶液为待测液;
② 取25.00 mL 待测液放入锥形瓶中,再加入适量的稀 H2SO4;
③ 用浓度为 0.05 000 mol·L-1 的 KMnO4标准溶液进行滴定。
(1)请写出滴定中发生反应的离子方程式________________________。
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是_____(选填 a、b)。
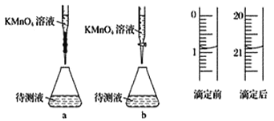
(3)由图可知消耗 KMnO4 溶液体积为________mL。
(4)滴定过程中眼睛应注视_______________,滴定终点锥形瓶内溶液的颜色变化为_______。
(5)通过上述数据,求得 x=_____。
a.若由于操作不当,滴定结束后滴定管尖嘴处有一气泡, 引起实验结果_____(填“偏大”、“偏小”或“无影响”);
b.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果_______(填“偏大”、“偏小”或“无影响”);
c.若在达到滴定终点时仰视读数,则所得结果________(填“偏大”、“偏小”或“无影响”);
d.若其它操作均正确,滴定前未用标准 KMnO4 溶液润洗滴定管,引起实验结果_________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
正极 | 负极 | 电解质溶液 | |
A | Zn | Cu | CuCl2 |
B | Zn | Cu | ZnCl2 |
C | Cu | Zn | CuSO4 |
D | Cu | Zn | ZnSO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PX是纺织工业的基础原料,其结构简式如下,下列说法正确的是( )
![]()
A. PX的一氯代物有3种 B. PX的分子式为C8H10
C. PX与乙苯互为同系物 D. PX分子中所有原子都处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B的结构简式如下:

(1)A分子中含有的官能团的名称是____________________________________。
(2)A、B能否与NaOH溶液反应:A________(填“能”或“不能”,下同),B________。
(3)A在浓硫酸作用下加热可得到B,其反应类型是____________________。
(4)A、B各1 mol分别加入足量溴水,完全反应后消耗单质溴的物质的量分别是________mol、________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com