
����Ŀ��[���ʽṹ������]2016��9���Ͽ���ѧѧ���״β�����һ������п���ӵ�أ��õ����Zn��CF3SO3��2Ϊ����ʣ�������������ȱ�ݵ�ZnMn2O4Ϊ�缫���ɹ��Ļ�����ȶ��Ĵ��ʵ�����
��1��д��Mnԭ�ӻ�̬��������Ų�ʽ ��
��2��CF3SO3H��һ���л�ǿ�ᣬ�ṹʽ��ͼ1��ʾ��ͨ���� CS2��IF5��H2O2��Ϊ��Ҫԭ����ȡ��
��1molCF3SO3H�����к��е���������ĿΪ mol��
��H2O2������Oԭ�ӵ��ӻ���ʽΪ ����CS2��Ϊ�ȵ�����ķ���Ϊ ��
��IF5��ˮ��ȫˮ�����������ᣬд����ػ�ѧ����ʽ�� ��
��3����п����Ĺ����ж��֣�����һ����п�ľ�����ͼ2���þ�����S2������λ��Ϊ ��
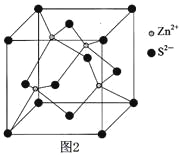
���𰸡���1��[Ar]3d54s2����2����8mol����sp3��CO2����IF5+3H2O��HIO3+5HF ����3��4��
�������������������1��Mn��25��Ԫ�أ�λ�ڵ�������VIIB��Ԫ�أ������Ų�ʽΪ��[Ar]3d54s2����2�����ɼ�ԭ�Ӽ�ֻ���γ�һ�����������1mol�������к���8mol��������H2O2�Ľṹ��ʽΪH��O��O��H���ӻ���������ڼ۲���Ӷ������۲���Ӷ���=����+�µ��Ӷ��������O�ļ۲���Ӷ���Ϊ4���ӻ�����Ϊsp3���ȵ�������ԭ��������ȣ��۵�����������ȵ����������CS2�ǵȵ��������CO2��������˫ˮ�ⷴӦ������ˮ��Ķ��壬�˷�ӦʽIF5��3H2O=HIO3��5HF����4��S2��λ�ڶ�������ϣ����Ӿ������λ���Ǿ���������������ĸ�������S2������λ����4��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ڵ����ʵ�˵������ȷ���ǣ�������
A.��������ˮ�γɶ��ij������������ӵ������۵��γɵ�����
B.������벻�������ʣ�û�е����ʾ�û�����������Ե�������������Ŀ�����
C.�����ʹ��ܵĶ�����ȡ������ṹ�Ķ�����
D.���д����õĵ���������Һ����ø�����ڸ��ź������Ϻϳɵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���� ��������
A. ��ӦNH3(g)+HCl(g)��NH4Cl(s)�������¿��Է���������÷�Ӧ����H<0
B. ���еĻ�ѧ��Ӧ����Ҫһ���Ļ�����ƶ�
C. CH3COOH ��Һ��ˮϡ�ͺ���Һ��![]() ��ֵ����
��ֵ����
D. Na2CO3��Һ�м�������Ca(OH)2 ���壬CO32��ˮ��̶ȼ�С����Һ��pH ��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��W��X��Y��Z��ԭ��������������Ķ�����Ԫ�أ�X��Y�ǽ���Ԫ�أ�Q��W��Z�Ƿǽ���Ԫ�أ�X��ͬ�����н�������ǿ��Ԫ�أ�����Ԫ�غ˵����֮��Ϊ55����Ӧԭ������������֮��Ϊ21��W��Z������������ͬ����Z�ĺ˵������W��2����
��1��Q�����ڱ���λ���� ��
��2��X��Y���Ե�����������Ӧ��ˮ������Է�����Ӧ�����κ�ˮ����д���÷�Ӧ�����ӷ���ʽ�� ��
��3��X��������W������ȼ�տ����ɻ�����R��R�ĵ���ʽ �� �����������е�����������������Ϊ ��
��4��Z���⻯����W��һ���⻯�����Ӧ������Z�ĵ��ʣ�д���仯ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���мס����������ʣ���һ�������£��������ܺ������и����ʶ���Ӧ����
���飺A.���� B.������ C.�������� D.����
���飺E.NaOH F.��ˮ G.��ȩ H.FeCl3
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ��У������ҹ���18�����С���1����(��������)Ϊ�����Ԫ�أ�ϡ������Ԫ���ǵ�18���С�����˵����ȷ����(����)
A.��Ԫ��λ�ڵ�3����
B.����Ԫ�������ڱ���ռ10������
C.��18��������Ԫ�ص���������8������
D.��16����Ԫ�ض��Ƿǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������H2S��H2CO3 �ĵ��볣�����±�
Ka1 | Ka2 | |
H2S | 9.1��10-8 | 1��10-15 |
H2CO3 | 4.3��10��7 | 5.6��10��11 |
��1���ٳ����£�0.1mol/L��������Һ��0.1mol.L-1��̼������Һ�����Ը�ǿ����_______����ԭ����_____________________________��
�� �����£�����ˮ������ӷ���ʽ_____________________________��
��2��H2S��������������ӷ�����Ӧ�������ܽ�Ȳ�ͬ������ɫ�Ľ�����������������ڷ���ͼ����������ӡ�
�ٳ����£�NaHS��Һ��______��ѡ��������������������������������
�ڳ����£���100 mL 0.1 mol��L��1 H2S��Һ�еμ�0.1 mol��L��1NaOH��Һ���õ���ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ��

�Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶�������________����b�㣬��Һ�и�����Ũ���ɴ�С������˳����______________________________��
��3���ѳ���Ȼ���е�������ܼ��ٻ�����Ⱦ���ֿɻ�������Դ���ò��������ù���NaOH��Һ���պ�����ʯī���缫������Һ�ɻ�����д�����õ�����ܷ�Ӧ����ʽ����������������ԭ��_______________���������������յĽǶȷ������÷��������ܼ��ٻ�����Ⱦ�������õ�һ�����ĸ���������е��ŵ���___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�ˮ�Ȳ�����������Ҳ���ǻ�ԭ����������ԭ��Ӧ��
A. Mg+2H2O=Mg(OH)2+H2�� B. 2F2+2H2O=4HF+O2
C. Na2O+H20=2NaOH D. 2Na2O2+2H2O=4NaOH+O2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com