
【题目】在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)zC(g),图1表示200℃时容器中A,B,C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( ) 
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04molL﹣1min﹣1
B.图2所知反应xA(g)+yB(g)zC(g)的△H>0,且a=2
C.若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆
D.200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5
【答案】BD
【解析】解:A.由图Ⅰ可知,200℃时5min达到平衡,平衡时B的物质的量变化量为0.4mol﹣0.2mol=0.2mol,故v(B)= ![]() =0.02 molL﹣1min﹣1 , 故A错误;B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0;图Ⅰ可知,200℃时平衡时,A的物质的量变化量为0.8mol﹣0.4mol=0.4mol,B的物质的量变化量为0.2mol,在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比=0.4mol:0.2mol=2,即a=2,故B正确;
=0.02 molL﹣1min﹣1 , 故A错误;B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0;图Ⅰ可知,200℃时平衡时,A的物质的量变化量为0.8mol﹣0.4mol=0.4mol,B的物质的量变化量为0.2mol,在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比=0.4mol:0.2mol=2,即a=2,故B正确;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动,故v(正)=v(逆) , 故C错误;
D.由图Ⅰ可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4mol、0.2mol、0.2mol,物质的量之比等于化学计量数之比,故x:y:z=0.4mol:0.2mol:0.2mol=2:1:1,平衡时A 的体积分数为 ![]() =0.5,200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,故达到平衡时,A 的体积分数小于0.5,故D正确;
=0.5,200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,故达到平衡时,A 的体积分数小于0.5,故D正确;
故选BD.
A.由图Ⅰ可知,200℃时平衡时,B的物质的量变化量为0.4mol﹣0.2mol=0.2mol,根据v= ![]() 计算v(B);
计算v(B);
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,据此判断反应热效应;在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,由图Ⅰ判断200℃时A、B的起始物质的量,据此计算a的值;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移;
D.由图1可知,达到平衡时,A的体积分数为0.5,200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,根据图Ⅰ中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,据此判断增大压强平衡移动方向.


科目:高中化学 来源: 题型:
【题目】有一在空气里暴露过的KOH固体样品,经分析其含水7.65%,含K2CO34.32%,其余是KOH。若将ag样品放入bmL1mol/L的盐酸中,使其充分作用后,残酸用25.25mLcmol/L的KOH溶液恰好中和完全。蒸发所得溶液,得到固体质量的表达式中(单位g)
A. 只含有a B. 只含有 b C. 必含有b D. 一定有a、b和c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 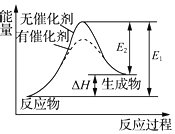
A.分子式为C2H4O的有机化合物性质相同
B.氯水和二氧化硫都具有漂白作用,两者漂白原理不相同
C.某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变
D.等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等
途径a:Cu ![]() CuO
CuO ![]() CuSO4;途径b:Cu
CuSO4;途径b:Cu ![]() CuSO4
CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5molL﹣1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL
B.45 mL
C.30 mL
D.15 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把5.1g镁铝合金的粉末放入过量的300mL 2molL﹣1盐酸中,得到5.6L H2(标准状况下).试计算:
(1)该合金中铝和镁的物质的量之比.
(2)在反应后的溶液中加入4molL﹣1 NaOH溶液,若要使沉淀量达到最大值,则加入的NaOH溶液的体积为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A~H八种物质存在如下图所示的转化关系(反应条件、部分产物未标出).已知A是酸式盐,B能使品红溶液褪色,G是红棕色气体,D和H是同一类物质. 
试回答下列问题:
(1)写出下列各物质的化学式:A、H .
(2)按要求写出下列反应的有关方程式 ①A→E反应的离子方程式;
②E→F 反应的化学方程式;
(3)常温下可以用铝制容器盛装浓D,是因为 , 将铁粉逐渐加入100ml浓H中直至过量,按先后顺序写出所发生反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下列有关我们常用的元素周期表的说法正确的是( )
A. 元素周期表有18个纵行,共有16个族
B. 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻
C. 短周期是指第一、二、三、四周期
D. IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等. 
(1)铜位于元素周期表区,基态铬原子的价电子排布式为 .
(2)碘酸及高碘酸的结构式如图1所示,酸性较强的是 , 理由是 .
(3)工业上制取单质可通过电解KHF2和HF混合溶液获得,HF2﹣中所包含的作用力有;与HF2﹣互为等电子体的分子为(任填一种).
(4)IO3﹣中碘原子的杂化轨道类型为 , IO3﹣的空间结构为 .
(5)用金属镁还原二氧化硅可得到一种硅镁化合物,其晶胞结构如图2所示.
已知Si4﹣位于晶胞的顶点和面心,Mg2+位于八个小立方体的中心,其晶体参数a=0.635nm.
①SiO2与SiF4相比,熔点更低的是(填化学式).
②硅镁化合物的化学式为;列式表示该硅镁化合物的密度:gcm﹣3(不必计算出结果,NA为阿伏伽德罗常数的数值).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com