
【题目】硒和硫是同一主族元素,二氧化硒(SeO2))是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1 :1,写出Se和浓HNO3的反应方程式_______________ 。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+2SO42-+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①__SeO2+__KI+__HNO3―→__Se+__I2+__KNO3+__H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平方程式①,用单线桥标出电子转移的方向和数目。__________________
(4)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
【答案】Se+2HNO3(浓) =SeO2 +NO↑+NO2 ↑ +H2O H2SO4(浓) > SeO2 > SO2 1 4 4 1 2 4 2 ![]() 92.5%
92.5%
【解析】
(1)根据题意,Se与浓硝酸或浓硫酸反应生成SeO2,Se与浓硝酸反应生成SeO2、NO和NO2,且NO和NO2物质的量之比为1:1,NO和NO2中N的价态共降低4价,Se的化合价升高4价,利用化合价升降法进行配平,即Se与浓硝酸反应的方程式为Se+2HNO3(浓)=SeO2+NO↑+NO2↑+H2O;
答案为Se+2HNO3(浓)=SeO2+NO↑+NO2↑+H2O;
(2)利用氧化剂的氧化性强于氧化产物的氧化性,第一个反应方程式中:H2SO4为氧化剂,SeO2为氧化产物,即H2SO4的氧化性强于SeO2,第二个反应方程式中:SeO2为氧化剂,SO2为还原剂,SO42-为氧化产物,即SeO2的氧化性强于SO42-,得出氧化性H2SO4(浓)>SeO2>SO2;
答案为H2SO4(浓)>SeO2>SO2;
(3)①SeO2中Se的化合价由+4价→0价,化合价降低4价,I-的化合价由-1价→0价,化合价升高1价,最小公倍数为4,利用化合价升降法进行配平,得出SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;用单线桥标出电子转移的方向和数目:![]() ;
;
答案为1,4,4,1,2,4,2;![]() ;
;
(4)根据(3)的反应方程式,建立SeO2~2I2~4Na2S2O3,m(SeO2)=![]() ,则SeO2的质量分数为
,则SeO2的质量分数为 ×100%=92.5%;
×100%=92.5%;
答案为92.5%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3的说法正确的是 ( )
A.在水中的溶解性:NaHCO3>Na2CO3
B.与质量分数相同的盐酸溶液反应放出气体的快慢:NaHCO3<Na2CO3
C.热稳定性:NaHCO3<Na2CO3
D.等质量的固体与足量盐酸反应放出CO2的质量Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.熔融NaCl能导电,是因为通电时NaCl发生了电离
B.NaCl固体不导电,因为NaCl固体中无带电微粒
C.NH4NO3电离时产生了NH![]() 、NO
、NO![]() ,无金属离子,所以NH4NO3不是盐
,无金属离子,所以NH4NO3不是盐
D.NaHSO4在水溶液中电离生成了Na+、H+、SO![]() 三种离子
三种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知破坏1 mol A—A键、1 mol B—B键、1 mol A—B键时分别需要吸收436 kJ、498 kJ、463 kJ的能量。反应2A2+B2![]() 2A2B的能量变化关系如图所示。下列说法中错误的是( )。
2A2B的能量变化关系如图所示。下列说法中错误的是( )。
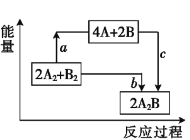
A. a=1370 kJB. b=482 kJ
C. 该反应是吸热反应D. 体系中A、B原子最活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100molL﹣1 NaOH溶液分别滴定20.00mL 0.100molL﹣1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
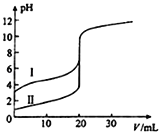
A. Ⅱ表示的是滴定醋酸的曲线
B. V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
C. pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
D. V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在中学化学中,KMnO4是常见的氧化剂之一。某实验小组收集整理了相关知识:
(1) KMnO4中Mn的化合价为_______。
(2) 实验室中可以加热分解KMnO4制取O2,其反应方程式为_______________。
(3) 实验中常在KMnO4溶液中加入适量稀硫酸,增加KMnO4的氧化性,但不宜用盐酸酸化,因为浓度较大时,KMnO4可能将Cl-氧化成Cl2,该反应中氧化剂和还原剂的物质的量之比为:____________ ,比较以下两种物质的氧化性:KMnO4_____________于Cl2(填“强”或“弱”)
(4) H2C2O4(草酸)是生物体的一种代谢产物,生活中常用作还原剂、除锈剂,将H2C2O4溶液滴入硫酸酸化的KMnO4溶液,当KMnO4被完全还原时,溶液颜色由_______变成无色,同时有无色气体生成。该反应方程式为:_____________________。
(5)某同学将KMnO4溶液加入H2O2溶液,却忘记了滴入稀硫酸,片刻后,有气泡产生,且出现黑色沉淀。该沉淀化学式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环与环之间共用两个或多个碳原子的多环烷烃称为桥环烷烃,其中二环[1.1.0]丁烷 (![]() )是其中一种。下列关于该化合物的说法正确的是
)是其中一种。下列关于该化合物的说法正确的是
A. 与C3H4是同系物
B. 一氯代物只有一种
C. 与环丁烯互为同分异构体
D. 所有碳原子可能都处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知亚硝酸钠能发生如下反应:2NaNO2+ 4HI= 2NO + I2 + 2NaI + 2H2O
(1)用双线桥表示电子转移的方向与数目__________。
(2)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为_________。
II.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
(1)该反应中还原产物为__________。
(2)每生成2molCuI,有__________mol KI被IO3-氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是______________(填序号)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学反应方程式:________________。
(3)怎样证明制得的物质是胶体?请简述操作过程:__________________。
(4)取少量制得的胶体加入试管中,再加入少量(NH4)2SO4溶液,观察到的现象是__________, 这种现象称为胶体的________________。
(5)Fe(OH)3胶体能稳定存在的主要原因是________(填序号)。
A. 胶粒直径小于1nm B. 胶粒带正电荷
C. 胶粒作布朗运动 D . 胶粒能透过滤纸
(6)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________(填序号)。
A. Fe(OH)3胶体粒子的直径在1~100nm之间
B. Fe(OH)3胶体具有丁达尔效应
C. Fe(OH)3胶体是均一的分散系
D. Fe(OH)3胶体的分散质粒子能透过滤纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com