
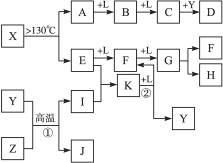
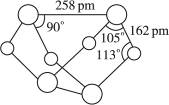
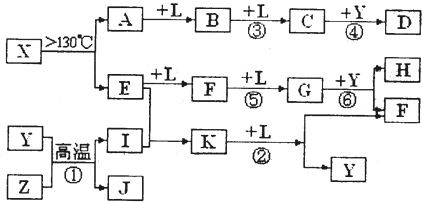
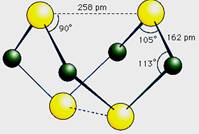
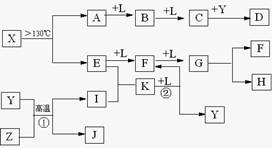
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J俗称磁性氧化铁,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。
试回答下列问题:
(1)写出化学式:D____________、X____________。
(2)E的电子式为________________________。
(3)写出化学方程式:①______________________________________;
②____________________________________________________________。
(1)H2SO4 S4N4 (或N4S4)
![]()
(3)3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
A为单质S,B的相对分子质量比A大32,相当于增加的为一分子氧气的相对分子质量,B可能为SO2,再结合“C的相对分子质量比B大16”可推知L为O2;“Z是常见的金属单质,J俗称磁性氧化铁”,可以推出Z为Fe;反应Y+Z→I+J为3Fe + 4H2O![]() Fe3O4+ 4H2,Y为H2O、I为H2,结合图示可知D为H2SO4;由X分子的球棍模型可知,形成X分子的两种元素分别形成三个共价键、两个共价键,即分别在ⅤA、ⅥA,结合单质E两步催化氧化可知E为N2,F为NO,G为NO2,那么K为NH3,4NH3+5O2
Fe3O4+ 4H2,Y为H2O、I为H2,结合图示可知D为H2SO4;由X分子的球棍模型可知,形成X分子的两种元素分别形成三个共价键、两个共价键,即分别在ⅤA、ⅥA,结合单质E两步催化氧化可知E为N2,F为NO,G为NO2,那么K为NH3,4NH3+5O2![]() 4NO+6H2O,再回扣检查一遍。
4NO+6H2O,再回扣检查一遍。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
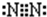
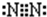
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁铁矿的主要成分,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。
试回答下列问题
(1)写出化学式:D X 。
(2)E的电子式为: 。
(3)写出化学方程式:① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
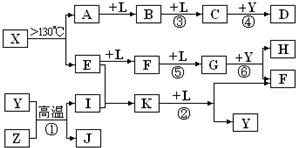
(10分)已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁,D、H、K均是重要的化工产品;X是结构有待探究的一种新型分子,其组成元素的相对原子质量相差18,下列框图中部分反应条件已略去。
试回答下列问题:
(1)E的结构式为___________,在反应①、②、③、④、⑤、⑥中属于非氧化还原反应的是___________。(填序号)
(2)写出反应②的化学方程式:_________________________________________
(3)若有G、F的混合气体通入足量烧碱溶液,气体全部被吸收,则气体G、F的物质的量之比应满足n(G)︰n(F)____________________
(4)J与过量H的稀溶液反应的离子方程式为___________________________________。
(5)t℃时,将2molE和1mol I通入体积为2L的恒温密闭容器中发生反应,2min后达到平衡n(K)=0.2mol, 此时保持温度不变,体积减半,则E的体积分数如何变化____________(填“增大”、“不变”、“变小”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com