
(1)甲烷通常用来作燃料,其燃烧反应的化学方程式是 。
(2) 若用甲烷—氧气构成燃料电池,电解质溶液为KOH溶液,试写出该电池的
正极的电极反应式 ;
负极的电极反应式 。
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2
 C.CH3CH2OH D.CH3CH2Br
C.CH3CH2OH D.CH3CH2Br
 (4)已知 2CH3CHO+O2 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
(4)已知 2CH3CHO+O2 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
反应②的化学方程式为____________________________________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____________________________________,反应类型是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下图所示的四个原电池装置,结论正确的是( )
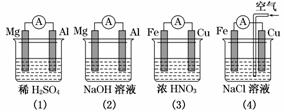
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为:6H2O+6e-===6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为:Fe-2e-===Fe2+
D.(4)中Cu作正极,电极反应式为:2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
在第3周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,最高价氧化物的水化物的碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为 、 ,原子半径最大的金属元素的名称是 ,离子半径最小的离子结构示意图是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解某溶液时,发现两极只有H2和O2生成,若电解前后温度变化忽略不计,则电解一段时间后,下列有关溶液叙述正确的有
①该溶液的pH可能增大②该溶液的pH可能减小③该溶液的pH可能不变④该溶液的浓度可能增大⑤该溶液的浓度可能减小⑥该溶液的浓度可能不变
A.①②③④⑤⑥ B.①②③④⑤
C.①②③④⑥ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素及其化合物性质的比较正确的是
A.原子半径:F<O<Al B.稳定性:H2O<PH3<NH3
C.酸性:H2CO3<H2SO4<H3PO4 D.碱性:LiOH<NaOH<Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2、
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3 ,则在电化学合成氨的过程中,正极反应式为 ;
2NH3 ,则在电化学合成氨的过程中,正极反应式为 ;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①A点时N2的浓度为 mol/L;
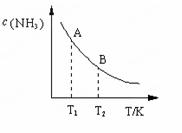 ②右图中在状态A时,平衡常数 KA =
②右图中在状态A时,平衡常数 KA =
(填写代入数值的表达式,不要求化简);当温度由T1变化到T2时,KA KB(填“>”、“ <”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 时间/min 浓度/mol•L—1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂
b.降低温度
c.增加H2的浓度
d.充入Ne增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
在含1 mol KAl(SO4)2的溶液中逐滴加入2 mol Ba(OH)2溶液,下列有关说法中正确的是
A.先生成沉淀,后沉淀全部溶解
B.当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大
C.最后得到的沉淀是BaSO4
D.最后的沉淀为2 mol BaSO4、1 mol Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com