


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
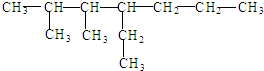 的命名中正确的是( )
的命名中正确的是( )| A、2,3-二甲基-4-丙基己烷 |
| B、2,3-二甲基-4-乙基庚烷 |
| C、4-乙基-2,3-二甲基庚烷 |
| D、5,6-二甲基-4-乙基庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
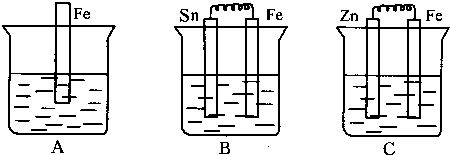
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| N(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
查看答案和解析>>
科目:高中化学 来源: 题型:
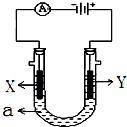 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向煤燃料中加入生石灰,可以减少对大气的污染 |
| B、维生素C高温时容易被破坏,所以不宜热锅爆炒蔬菜 |
| C、可用燃烧的方法鉴别真丝围巾和合成纤维围巾 |
| D、氟利昂(CCl2F2)可以破坏臭氧层,从而导致温室效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com